|
|
원자번호 41번, 나이오븀. <출처: (CC)W. Oelen at Wikipedia.org> |
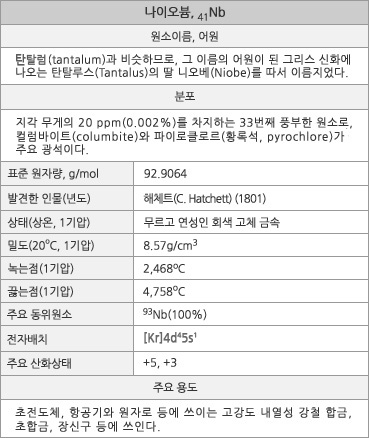
나이오븀의 원소 정보. |
|
나이오븀의 역사와 분리∙발견, 원소명 명명

|
|
|
|

양극산화처리한 나이오븀 입방체(왼쪽)와 고순도의 나이오븀 결정(오른쪽). <출처: (CC)Alchemist-hp at Wikipedia.org>
|
화학적 성질

|
|
|
|
|
나이오븀은 자동차 차체와 가스관 등으로 사용되는 고강도저합금(HSLA) 강철 생산에 주로 사용된다. <출처: gettyimages> |
나이오븀 초합금은 내열성이 매우 좋아 로켓 추진체 노즐 등으로 사용된다. |
|
|
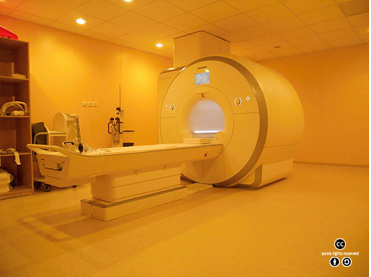
의료 진단에 중요하게 사용되는 자기공명영상(MRI) 스캐너는 대부분 나이오븀 초전도 합금을 전선으로 사용한 초전도자석으로 강한 자기장을 얻는다. <출처: (CC)Tomáš Vendiš at Wikipedia.org> |
캐나다에서 2011년에 주조된 액면 5$짜리 수렵월 주화. 은/나이오븀으로 되어있는데, 나이오븀을 선택적으로 산화시켜 각기 다른 색과 무늬를 만든다. <출처: 캐나다왕립조폐국> |
|

나이오븀은 가볍고 피부반응을 거의 나타내지 않고 양극 산화로 여러 가지 다양한 색을 낼 수 있어 장신구로 많이 사용된다.
<출처: (CC)The ChainMaille Lady at flickr.com>
|
-
 수치로 보는 나이오븀
수치로 보는 나이오븀
나이오븀의 표준원자량은 92.9064g/mol이다. 원자의 바닥 상태 전자배치는 1s22s22p63s23p63d104s24p64d45s1([Kr]4d45s1)이며, 화합물에서는 주로 +5의 산화상태를 갖는다. 지각 무게의 약 20ppm(0.002%)를 차지하는 33번째로 풍부한 원소이다. 2009년 이후 전세계 연간 생산량은 약 63,000톤으로 유지되며, 이의 80% 이상은 페로나이오븀으로 생산되어 주로 강철 합금제로 사용된다. 1기압에서 녹는점은 약 2468oC, 끓는점은 4758oC, 그리고 20oC에서의 밀도는 8.57g/cm3이다. 첫 번째, 두 번째, 세 번째 이온화 에너지는 각각 652.1, 1380, 2416kJ/mol이며, 폴링의 전기음성도는 1.6이다. 원자 반경은 146pm이고, 6배위된 Nb5+의 이온 반경은 64pm인데, 탄탈럼의 원자 및 이온반경과 거의 같다. 천연 상태에서는 안정한 핵 종인 93Nb로만 있다. -
 초전도체(superconductor)
초전도체(superconductor)
전기저항이 0에 가까운 물질이 초전도체이다. 초전도 현상을 보이는 물질도 특정 온도(임계온도, Tc) 이하에서만 초전도 성질을 나타낸다. 초전도체는 큰 전류를 흘려도 열이 발생하지 않아, 이를 전선으로 사용하면 20%에 달하는 송전시의 에너지 손실을 막을 수 있고 전기∙전자 기기를 소형화시키고 에너지 효율적으로 작동하도록 한다. 초전도체는 내부로는 자기장이 들어갈 수 없으며, 또 내부에 있던 자기장도 밖으로 밀어내는 성질(마이스너 효과)이 있다. 이런 특성 때문에 자석 위에 떠오르는 자기부상현상이 나타난다. 초전도체는 외부 자기장의 세기가 어떤 임계치 이상으로 커지면 초전도 상태가 바로 무너지는 제1종 초전도체와 이런 무너짐이 상당히 넓은 자기장 세기 범위에서 일어나는 제2종 초전도체로 구분된다. 제2종 초전도체는 초전도 성질을 잃는 임계 자기장 세기가 비교적 크므로, 초전도자석, 초전도 송전, 고주파용 재료 등의 이용에 보다 적합하다. 원소 상태에서는 바나듐(V), 나이오븀(Nb), 테크네튬(Tc)만이 제2형 초전도체이며, 세라믹 초전도체들은 보통 제2종 초전도체 성질을 보인다. -
 초전도자석(superconducting magnet)
초전도자석(superconducting magnet)
초전도체를 코일 전선으로 사용하는 전자석이다. 코일에 아주 강한 세기의 전류를 흘릴 수 있으므로 매우 강한 자기장을 얻을 수 있다. 보통은 강한 자기장에서도 초전도 성질을 유지하는 제2종 초전도체를 사용한다. 초전도 전자석은 자기공명영상(MRI) 및 핵자기공명(NMR) 장치, 입자가속기 등에 사용되며, 전력 에너지 저장 수단으로 이용될 수도 있다.
발행일 2012.06.06
Niobium
Atomic Weight
92.90638
Density
8.57 g/cm3
Melting Point
2477 °C
Boiling Point
4744 °C
Full technical data
This is high purity niobium crystal ribbon from Russia. New methods have made this form obsolete, and most was melted down. It is used in earrings and tongue studs because it can be colored by oxidation.
Scroll down to see examples of Niobium.
'Natural science > 화 학' 카테고리의 다른 글
| Technetium(Tc), 43-테크네튬 (0) | 2012.07.04 |
|---|---|
| Molybdenum(Mo), 42-몰리브데넘 (0) | 2012.07.04 |
| Zirconium(Zr), 40-지르코늄 (0) | 2012.07.04 |
| 21세기 최고의 자원으로 떠오른 희토류 (0) | 2012.07.04 |
| Yttrium(Y), 39-이트륨 (0) | 2012.07.04 |