|
|
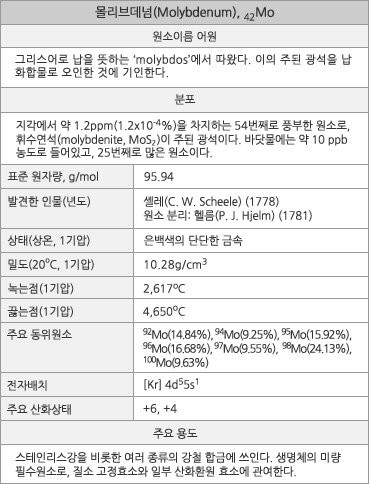
원자번호 42번, 몰리브데넘. |
몰리브데넘의 원소 정보. |
|
몰리브데넘의 발견, 역사, 원소의 명명

|
|
|

몰리브데넘 결정과 고순도 입방체. <출처: (CC)Alchemist-hp at Wikipedia.org>
물리적 성질

|
|
|
|
|
|
|
|
제1차 세계대전 시 몰리브데넘 합금으로 제작된 독일의 곡사포 '빅 버사'. 장갑용 강철의 합금제로 사용되어온 텅스텐의 늘어난 수요를 감당하지 못하게 되자, 텅스텐 대신에 몰리브데넘을 사용하게 되었다. |
몰리브데넘은 내부식성과 강도가 강한 합금을 얻는 데도 사용되는데, 대부분의 고강도 강철 합금에는 0.25%~8%의 몰리브데넘이 포함되어 있다. <출처: Chida Tungsten & Molybdenum Products Co., Ltd> |
|
|
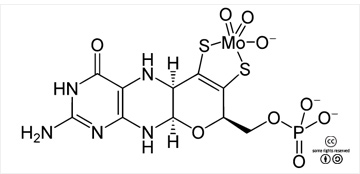
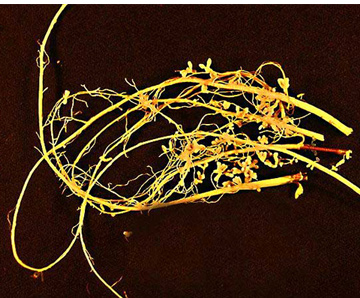
몰리브데넘의 생물학적 역할

|
|
|
|
|
|
|
-
 수치로 보는 몰리브데넘
수치로 보는 몰리브데넘
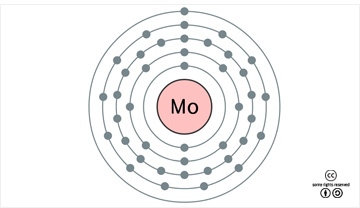
몰리브데넘의 표준원자량은 95.94g/mol이다. 원자의 바닥 상태 전자배치는 1s22s22p63s23p63d104s24p64d55s1([Kr]4d55s1)이며, 화합물에서 주된 산화 수는 +6이다. 지각에서의 존재비는 약 1.2 ppm(1.2x10-4%)로, 54번째로 풍부한 원소이다. 바닷물에는 약 10ppb농도로 들어있고, 25번째로 많은 원소이다. 전세계 연간 생산량은 약 25만 톤인데, 이의 80% 이상은 합금 제조에 사용된다. 광석 매장량은 약 2,000만 톤으로 추정된다. 1기압에서 녹는점은 2.617oC이고, 끓는점은 4,650oC이며, 25oC에서 밀도는 10.28g/cm3이다. 20oC에서 전기비저항은 53.4nΩ∙m이며, 25oC에서 열 전도율은 138W∙m-1∙K-1이이다. 첫 번째, 두 번째, 세 번째 이온화 에너지는 각각 684.3, 1560, 2618 kJ/mol이며, 폴링의 전기음성도는 2.16이다. 원자 반경은 139 pm(비교: W, 139pm)이고, 6배위된 Mo6+ 이온의 반경은 59 pm(비교: W6+, 60pm)이다. 천연 동위원소는 92Mo(14.84%), 94Mo(9.25%), 95Mo(15.92%), 96Mo(16.68%), 97Mo(9.55%), 98Mo(24.13%), 100Mo(9.63%)의 7가지가 있는데, 100Mo는 반감기가 7.8x1018년인 방사성 동위원소로 두 번의 β- 붕괴를 하고 100Ru이 된다.
발행일 2012.06.20
Molybdenum
Pure molybdenum is used in specialized high temperature applications because it maintains its strength better than molybdenum steel, a common high-strength alloy. Large pure bars like this are unusual. Scroll down to see examples of Molybdenum. | |||||||||||||||||
'Natural science > 화 학' 카테고리의 다른 글
| Ruthenium(Ru), 44-루테늄 (0) | 2012.07.04 |
|---|---|
| Technetium(Tc), 43-테크네튬 (0) | 2012.07.04 |
| Niobium(Nb), 41-나이오븀 (0) | 2012.07.04 |
| Zirconium(Zr), 40-지르코늄 (0) | 2012.07.04 |
| 21세기 최고의 자원으로 떠오른 희토류 (0) | 2012.07.04 |