산화환원반응
다른 표기 언어 oxidation-reduction reaction , 酸化還元反應
ⓒ chromatos/Shutterstock.com | 저작권자의 허가 없이 사용할 수 없습니다.
전자가 화학반응에 미치는 영향이 밝혀지기 전에는 산화반응은 단지 원소가 산소 원자를 얻는 반응, 즉 탄소의 연소과정(C+O2→CO2)과 철의 부식과정(4Fe+3O2→2Fe2O3)에 한정되었으며, 환원반응은 산소를 잃는 반응, 즉 수소에 의한 구리의 환원반응(CuO+H2→Cu+H2O)만을 나타냈다(환원).
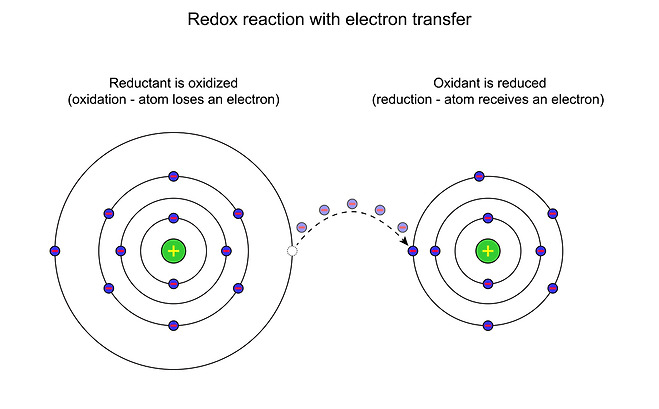
오늘날 대부분의 산화환원반응은 산소 원자, 수소 원자 또는 전자의 이동과 관련된 모든 반응을 말한다.
산화반응이 일어나면 반드시 환원반응도 함께 일어나는 것이 특징적이다. 예를 들면 히드라진이 수소를 잃고 질소 기체로 산화될 때 산소는 수소를 얻어 물로 환원된다. 반응식은 다음과 같다.
N2H4 → N2+2H2O
수용액에서 대부분의 물질은 이온화한다.
예를 들면 염화니켈(NiCl2)은 수용액에서 니켈 양이온과 염소 음이온으로 해리된다. 반응식은 다음과 같다.
NiCl2 → Ni2++2Cl-
이러한 수용액을 전기분해시키면 양극에서는 산화반응이, 음극에서는 환원반응이 일어난다.
NiCl2 수용액을 전기분해시킬 때 양극반응은 2Cl- → Cl2+2e-이며, 음극반응은 Ni2++2e- → Ni이다. 전자이동에 의한 이러한 반응은 반쪽반응 또는 산화환원짝이라고 한다. 이론적으로 모든 산화환원반응은 전자이동에 의한 메커니즘을 나타내는 2개의 반쪽반응으로 나누어진다.
또한 산화환원반응은 동시에 일어나며 등가반응(等價反應)으로 전자를 잃은 수와 얻은 수가 같다. 두 짝반응의 상대전위는 반응이 진행하는 방향을 결정한다. 가장 강력한 환원제들은 나트륨 같은 전기양성도가 매우 큰 금속들인데, 이들은 귀금속화합물들을 쉽게 환원시키거나 물분자로부터 수소를 발생시킨다. 가장 강력한 산화제인 플루오르와 오존은 물분자로부터 쉽게 산소를 발생시킨다.
산화환원반응에 참여하는 원자의 상태는 그 원자가전자를 원소상태보다 많이 또는 적게 갖고 있는지를 나타내는 산화수로 표시한다.
예를 들어 Na+ 이온은 전자 1개가 부족하기 때문에 산화수는 +1이며, 황산 이온(SO42-)의 경우 전체 산화수는 -2가 된다. 구성 원자의 산화수의 합으로 전체 산화수를 표시하고, 따라서 각 구성원자의 산화수 계산은 다음과 같이 한다. 산소 원자는 각각 2개의 여분의 전자를 더 가질 수 있으므로 황산 이온에서 4개의 산소 이온에 의한 산화수는 -8이고, 황의 산화수는 +6이므로 전체적으로 황산 이온의 산화수는 -2가 된다.
전기적으로 중성인 물질의 산화수의 합은 0이다. 이러한 예로 황산나트륨(Na2SO4)을 들 수 있는데 2개의 나트륨 원자의 산화수 합은 +2이고, 황산 이온의 산화수는 -2이므로 전체 산화수는 0이다. 산화환원반응에서 전자를 잃어 산화되면 원자나 이온의 산화수가 증가하는 반면에 산화수의 감소는 환원반응이 일어났음을 뜻한다.
특정 원소들은 여러 화합물에서 동일한 산화수를 가지나, 전이금속원소들은 여러 가지 산화수를 가진다.
화학원소 중 전기음성도가 가장 큰 플루오르는 산화수가 -1로 모든 플루오르 화합물에서 같으나, 질소는 -3(암모니아, NH3)과 +5(질산, HNO3) 사이의 산화수를 가지는 경우도 있다. 무기화합물의 명명법에서 하나 이상의 산화수를 갖는 원소가 화합물을 만들 때는 염화철(Ⅱ)(FeCl2), 염화철(Ⅲ)(FeCl3)과 같이 원소이름 뒤의 괄호 안에 로마 숫자를 써서 원소의 산화수를 표기한다.
'Natural science > 화 학' 카테고리의 다른 글
| 열가소성 수지 대 열경화성 수지 (0) | 2020.04.20 |
|---|---|
| colored Glass chemistry (0) | 2020.01.28 |
| Alcohol -알콜올 (0) | 2020.01.15 |
| 증류수 용출 ph 측정 (0) | 2018.04.05 |
| 생뚱맞게 우연한 발명품 (0) | 2018.03.23 |