|
|
원자번호 22번, 타이타늄. 블랙버드라는 별명으로 알려진 ‘SR-71’은 대부분 타이타늄으로 제작되었다. |
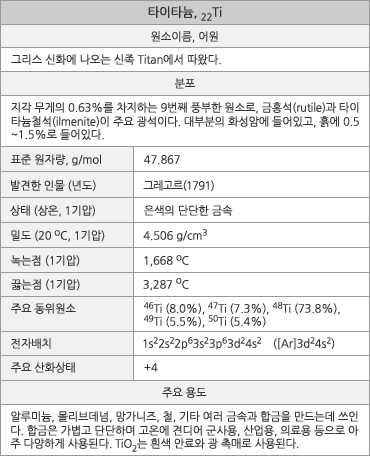
타이타늄의 원소 정보. |
|

순도 99.995%의 타이타늄 수정 바. <출처: (CC)Alchemist-hp at Wikipedia.org>
|
|
1791년, 영국의 그레고르는 냇가에서 검은 물질(타이타늄철석)을 모으고 이를 조사하여, 철 산화물 외에 들어 있던 새로운 원소의 흰색 산화물을 발견한다. |
1795년, 클라포르트는 그레고르가 발견한 새 원소가 자신이 금홍석에서 발견해 타이타늄이라 명명한 원소였음을 확인한다. |
|
물리적 성질

|
|
|
|
|
금속 타이타늄의 이용

|
|
|
|
타이타늄 반지. 타이타늄은 생체 적합성이 탁월한 것으로 여겨져 장신구 제작에 사용되기도 한다. |
프랭크 게리가 디자인한 것으로 유명한 빌바오의 구겐하임 미술관은 외관을 타이타늄 패널로 둘러쌌다. <출처: sxc.hu> |
|
|
|
|

질화타이타늄은 드릴 비트 등 내마모성을 필요로 하는 물품에 코팅되어 사용된다. <출처: (CC)Binter at wikipedia.org>
|
- 타이타늄/티타늄
원자번호 22번 원소(Ti)의 IUPAC(International Union of Pure and Applied Chemistry, 국제 순수ㆍ응용화학 연합) 이름은 ‘titanium’이며, 이의 발음은 타이타늄에 가깝다. 독일과 이에 영향을 받은 일본 등에서는 티탄(titan)이라 부르는데, 우리나라에서도 이를 공식적인 이름으로 사용하였다. 그러나 대한화학회는 ‘독일어 이름이나 독일어식 표기로 나타내던 원소의 이름을 모두 IUPAC이름으로 바꾼다’는 원칙을 세우고 티탄대신 타이타늄으로 부르기로 하였는데, 이는 2007년에 교과부 편수자료로 채택되었다. 따라서 현재의 공식 우리말 이름은 타이타늄이다. 티타늄이란 명칭도 자주 사용되고 있다.
- 수치로 보는 타이타늄
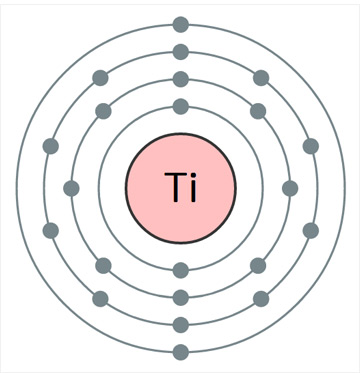
타이타늄의 표준원자량은 47.867g/mol이다. 원자의 바닥 상태 전자배치는 1s22s22p63s23p63d24s2 ([Ar]3d24s2)이며, 화합물에서 주된 산화 수는 +4이다. 지각 무게의 약 0.63%를 차지하는 9번째로 풍부한 원소이다. 금속 타이타늄의 약 90%는 타이타늄철석에서 얻는데, 이 광석의 전세계 매장량은 TiO2로 환산해서 약 10억 톤으로 추정된다. 금홍석의 추정 매장량은 TiO2로 환산해서 약 2억3000만 톤으로 추정된다. 1기압에서 녹는점은 1,668oC이고 끓는점은 3,287oC이다. 20oC에서 밀도는 4.506g/cm3로, 철의 약 45%이다. 20oC에서 전기비저항은 420nΩ∙m이며, 열 전도율은 21.9 W∙m-1∙K-1이다. 모스 경도는 6.0이며, 인장 강도는 약 434Mpa이다. 첫 번째, 두 번째, 세 번째 이온화 에너지는 각각 658.8, 1309.9, 2652.5kJ/mol 이며, 폴링의 전기음성도는 1.54이다. 원자 반경은 147pm이고, 6배위된 Ti4+의 이온 반경은 60.5pm이다. 천연 동위원소는 5가지가 있는데, 모두 안정하다.
- 광 촉매
빛을 흡수하여 일어나는 화학반응(광화학 반응)의 속도를 증대시키는 물질이다. TiO2가 대표적인 광 촉매인데, 빛을 흡수하면 전자-정공 쌍(electron-hole pair)이 만들어진다. 어떤 물질이 정공에 전자를 주면 다른 물질이 이 전자를 받아들여 환원되고 TiO2는 원래의 상태로 되돌아 간다. 반대로 어떤 물질이 전자-전공 쌍에서 전자를 받게 되면, 다른 물질이 정공에 전자를 주고 산화된다. 이런 과정으로 빛에 의해 산화-환원 반응이 일어나게 된다.
발행일 2012.01.25
Titanium
| Atomic Weight | 47.867 | |
| Density | 4.507 g/cm3 | |
| Melting Point | 1668 °C | |
| Boiling Point | 3287 °C | |
| Full technical data | ||
This titanium blisk (bladed impeller disk) is from the intake stage of a jet engine, where the light weight and high strength of titanium are key. Titanium is expensive because it must be cast under inert atmosphere.
Notes on the properties of Titanium:
Specific Heat: Value given for solid phase.
Up to date, curated data provided by Mathematica's ElementData function from Wolfram Research, Inc.
'Natural science > 화 학' 카테고리의 다른 글
| Chromium ( Cr ), 24- 크롬 (0) | 2012.03.01 |
|---|---|
| Vanadium ( V ), 23-바나듐 (0) | 2012.03.01 |
| 희토류 - 란타넘(란탄계)15개, 스칸듐(21-Sc), 이트륨(39-Y) (0) | 2012.03.01 |
| Scandium ( Sc ), 21-스칸듐 (0) | 2012.03.01 |
| 탄산칼슘(Calcium carbonate) (0) | 2012.03.01 |