|
|
원자번호 24번, 크로뮴. <출처: (CC)Atoma at wikipedia.org> |
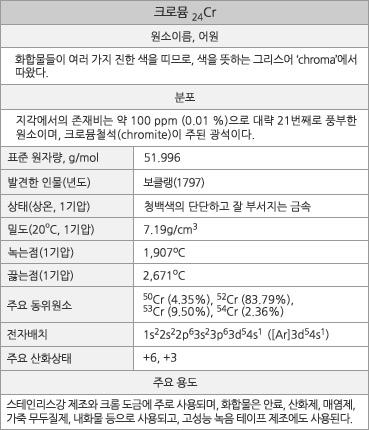
크로뮴의 원소 정보. |
|
|
|
|

고순도의 크로뮴 결정과 크로뮴 입방체. <출처: (CC)Alchemist-hp at Wikipedia.org>
|
화학적 성질

|
|
크로뮴의 생산

|
|
|
|
전세계 페로크로뮴 생산량의 80% 이상이 스테인리스 강 생산에 사용된다. |
모발 건조기의 내부. 금속 크로뮴과 니켈의 합금인 니크롬은 전기 저항이 크고 녹는점이 높아 모발 건조기, 전기 오븐 등 전열 기구에 사용된다. |
|
|
|
|

크로뮴(III)이 불순물로 들어 있어 아름다운 색을 내는 보석 루비(왼쪽)와 에메랄드(오른쪽). <출처: (CC)Rob Lavinsky at wikipedia.org>
|
- 크로뮴/크롬 명칭
원자번호 24번 원소(Cr)의 IUPAC(International Union of Pure and Applied Chemistry, 국제 순수ㆍ응용화학 연합) 이름은 ‘chromium’이며, 우리 말로 ‘크로뮴’이라 적는다. IUPAC 명명법이 정해지기 전의 이름은 크롬(chrome)인데, 이는 여전히 여러 나라에서 사용되고 있으며 우리나라에서도 그 동안 사용하여왔다. 그러나 대한화학회는 외래어로 나타낸 원소 이름을 모두 IUPAC 이름으로 바꾼다는 원칙을 세우고, 크롬대신 크로뮴으로 부르기로 하였으며, 이는 2007년에 교과부 편수자료로 채택되었다.
- 수치로 보는 크로뮴
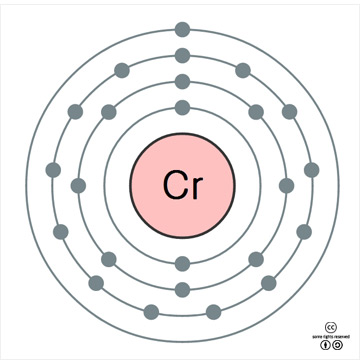
크로뮴의 표준원자량은 51.996g/mol이다. 원자의 바닥 상태 전자배치는 1s22s22p63s23p63d54s1([Ar]3d54s1)이고, 화합물에서 주된 산화 수는 +6과 +3이며, +3 상태가 가장 안정하다. 지각에서의 존재 비는 약 100ppm(0.010%)이다. 1기압에서 녹는점은 1,907oC이고 끓는점은 2,671oC이며, 20oC에서 밀도는 7.19g/cm3이다. 20oC에서 전기비저항은 125nΩ∙m이며, 열 전도율은 93.9W∙m-1∙K-1이다. 첫 번째, 두 번째, 세 번째 이온화 에너지는 각각 652.9, 1590.6, 2987kJ/mol 이며, 폴링의 전기음성도는 1.66이다. 원자 반경은 126pm이고, Cr3+ 이온(6 배위체)의 반경은 62pm(참고로 Al3+는 54pm)이다. 천연 동위원소는 4가지가 있는데, 52Cr이 83.79%를 차지한다.
발행일 2012.02.08
Chromium
| Atomic Weight | 51.9961 | |
| Density | 7.14 g/cm3 | |
| Melting Point | 1907 °C | |
| Boiling Point | 2671 °C | |
| Full technical data | ||
Many shiny things are chrome-plated; these chips show the result if you keep plating until a thick slab is built up. This process, called electrowinning, is how high-purity chromium is obtained from solution.
Notes on the properties of Chromium:
Specific Heat: Value given for solid phase.
Up to date, curated data provided by Mathematica's ElementData function from Wolfram Research, Inc.
'Natural science > 화 학' 카테고리의 다른 글
| Manganese ( Mn ), 25- 망간, 망가니즈 (0) | 2012.03.01 |
|---|---|
| 계면활성제 (0) | 2012.03.01 |
| Vanadium ( V ), 23-바나듐 (0) | 2012.03.01 |
| Titanium ( Ti ), 22- 타이타늄(티타늄) (0) | 2012.03.01 |
| 희토류 - 란타넘(란탄계)15개, 스칸듐(21-Sc), 이트륨(39-Y) (0) | 2012.03.01 |






 Cr2O72-
Cr2O72- 

