|
|
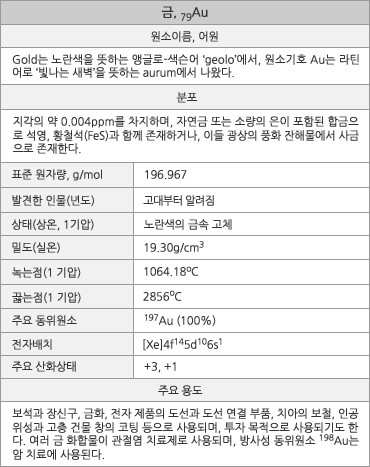
원자번호 79번, 금. |
금의 원소 정보. |
|
금의 역사

|
금은 인류 역사의 시작과 더불어 화폐 가치의 기준이 되어왔다. 금이 금화로 사용되면서 금의 확보는 곧 부를 확보하는 것이 되었고, 인류는 더 많은 금을 얻기 위해 침략 전쟁을 벌이기도 했다. |
투탕카멘. 고대 이집트 인들은 태양을 신으로 숭배하였으며, 금은 태양을 상징하는 것으로 여겼다. <출처: (CC)Bjørn Christian Tørrissen at Wikipedia.org> |
|
금의 물리적 성질

|
|
|
|
|
|
금 나노입자

|
|
|
금의 생산과 회수

|
괴금. <출처: (CC)Rob Lavinsky at Wikipedia.org> |
산금. <출처: (CC)Rob Lavinsky at Wikipedia.org> |
사금. |
|
금의 거래 단위와 순도

|
|
|
|
골드바. 투자용으로 사용되는 금. <출처: gettyimages> |
집적회로에 사용된 금. 금은 좋은 전기 전도체이고 부식성이 없기 때문에 집적회로 등에 많이 사용된다. |
|
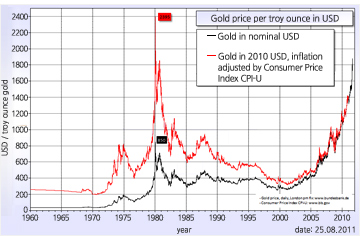
- 수치로 보는 금
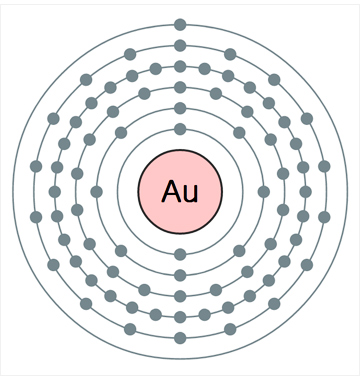
금의 표준원자량은 196.967g/mol이다. 원자의 전자배치는 1s22s22p63s23p63d104s24p64d105s25p64f145d106s1([Xe]4f145d106s1)이며, 화합물에서의 주된 산화수는 +3, +1이다. 지각 암석에서 존재비는 0.004ppm이고, 바닷물에는 0.01~0.03ppt(parts per trillion: 1 ppt는 1조(1012)분의 1)의 농도로 들어있다. 녹는점은 1064.18oC 이고, 끓는점은 2856oC이다. 녹음열과 증발열은 각각 12.55kJ/mol과 324kJ/mol이다. 첫 번째와 두 번째 이온화 에너지는 각각 890.1과 1980kJ/mol이다. 폴링의 전기음성도는 2.54(비교: C, 2.55; S, 2.58; Se, 2.55; I, 2.66)이고, 전자 친화도는 222.8kJ/mol(비교: Cu, 119.2kJ/mol; Ag, 125.6kJ/mol)이다. 20oC에서 전기전도도는 4.26x107S∙m-1(비저항은 23.5nΩ∙m)이고, 열전도율은 318W∙m-1∙K-1이다. 자연 상태의 동위원소는 197Au(100%)이다.
발행일 2011.12.07
Gold
| Atomic Weight | 196.96655 | |
| Density | 19.3 g/cm3 | |
| Melting Point | 1064.18 °C | |
| Boiling Point | 2856 °C | |
| Full technical data | ||
Gold is one of the few elements you can find just lying on the ground. This one-ounce nugget of pure gold was found in Alaska in 1890 by Hogamorth Marion, while on a trip to sell shoes to Eskimos. Seriously.
Notes on the properties of Gold:
Specific Heat: Value given for solid phase.
Up to date, curated data provided by Mathematica's ElementData function from Wolfram Research, Inc.
'Natural science > 화 학' 카테고리의 다른 글
| 마리 퀴리 (Marie Curie) 1867.11.7~ 1934.7.4 (0) | 2012.03.01 |
|---|---|
| Radium( Ra ), 88-라듐 (0) | 2012.03.01 |
| 술 ( alcohol ), 에탄올 (0) | 2012.03.01 |
| Nickel ( Ni ), 28 - 니켈 (0) | 2012.03.01 |
| Cobalt ( Co ), 27 - 코발트 (0) | 2012.03.01 |





 HCl
HCl