|
|
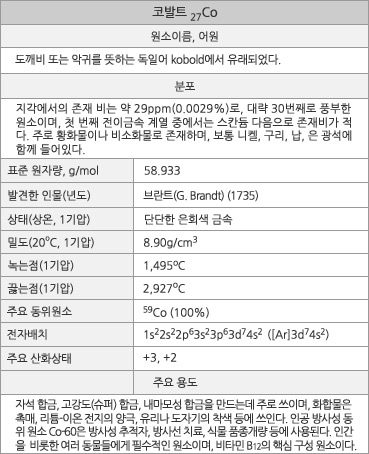
원자번호 27번, 코발트. |
코발트의 원소 정보. |
|
역사와 분리∙발견

|
|
|

코발트 조각과 고순도 입방체(왼쪽). <출처: (CC)Alchemist-hp at Wikipedia.org>
|
화학적 성질

|
|
|
|
초합금으로 제작된 제트 엔진 터빈의 날개 부분. 코발트의 약 22%는 초합금 생산에 사용된다.(2006년 기준) <출처: (CC)Stahlkocher at Wikipedia.org> |
알니코 자석. 코발트가 들어간 자석 합금 중 대표적인 것으로 1931년에 개발되었다. <출처: (CC)Zureks at Wikipedia.org> |
|
|
유럽에서 중세 이후에 개발된 화감청은 산화코발트를 이용해 만들며, 투명한 푸른 유리를 제작하는 데 사용되었다. <출처: (CC)Wikipedia Loves Art photo pool at Wikipedia.org> |
리튬-이온 전지는 양극 물질로 LiCoO2를 사용한다. <출처: (CC)Kristoferb at Wikipedia.org> |
|
|
|
|
|
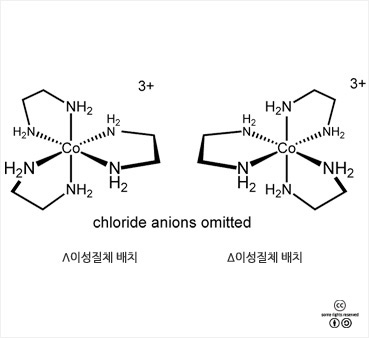
[Co(en)3]Cl3의 두 가지 광학 이성질체 |
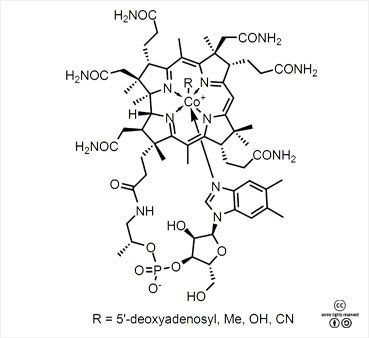
코발아민(비타민 B12)의 구조 |
|
- 수치로 보는 코발트
코발트의 표준원자량은 58.933g/mol이다. 원자의 바닥 상태 전자배치는 1s22s22p63s23p63d74s2 ([Ar]3d74s2)이며, 화합물에서 주된 산화 수는 +2와 +3이다. 지각에서의 존재 비는 약 29ppm(0.0029%)이다. 1기압에서 녹는점은 1,495oC이고 끓는점은 2,927oC이다. 에너지가 비슷한 2가지 동소체가 있으며, 20oC에서 밀도는 8.90g/cm3이다. 첫 번째, 두 번째, 세 번째 이온화 에너지는 각각 760.4, 1648, 3232kJ/mol이며, 폴링의 전기음성도는 1.88이다. 원자 반경은 125pm이고, Co2+ 이온(6 배위체)의 반경은 낮은 스핀 상태는 65pm, 높은 스핀 상태는 74.5pm이다. 천연 동위원소는 안정한 59Co뿐이다. 전세계 광석 매장량은 약 1,300만 톤으로 추정되며, 2009년도 전세계 총 생산량은 약 72,300톤이었다. 콩고 공화국이 전세계 매장량의 35%, 생산량의 약 50%를 차지한다.
- 화감청(花紺靑, smalt)
유리나 도자기에서 푸른 색을 내는 데 사용되는 것으로, 화학적으로는 산화포타슘(포타쉬, K2O), 실리카(SiO2), 산화코발트(CoO)의 혼합물을 녹여 유리로 만든 후 이를 가루로 만든 것이다. 고대부터 사용되었으나 제조법이 분실되었다가, 15세기에 재발견되었다. 레오나르도 다 빈치가 이를 새로운 안료로 처음 사용하였다.
발행일 2012.02.22
Cobalt
| Atomic Weight | 58.9332 | |
| Density | 8.9 g/cm3 | |
| Melting Point | 1495 °C | |
| Boiling Point | 2927 °C | |
| Full technical data | ||
Cobalt is used in pigments, notably cobalt blue, and in high-strength, high-temperature steel alloys. High purity cobalt is obtained by electrolyzing cobalt ions out of solution, resulting in bumpy plate like this.
Notes on the properties of Cobalt:
Specific Heat: Value given for solid phase.
Up to date, curated data provided by Mathematica's ElementData function from Wolfram Research, Inc.
'Natural science > 화 학' 카테고리의 다른 글
| 술 ( alcohol ), 에탄올 (0) | 2012.03.01 |
|---|---|
| Nickel ( Ni ), 28 - 니켈 (0) | 2012.03.01 |
| 전지, 배터리 (0) | 2012.03.01 |
| 리튬 이온 전지 (0) | 2012.03.01 |
| 빈혈Anemia (0) | 2012.03.01 |



 [Co(H2O)6]2+ Eo = 1.83 V
[Co(H2O)6]2+ Eo = 1.83 V