|
|
원자 번호 33번, 비소. <출처: gettyimages> |
비소의 원소 정보. |
|
비소의 역사

|
|
|
물리적 성질: 동소체와 동위원소

|
|
|
화학적 성질

|
|
|
|
|
자동차 등에 사용되는 납 축전지에 납-안티모니-비소 합금이 사용되었다. |
비소화 갈륨(GaAs)은 반도체, 발광 다이오드(LED), 집적 회로 등에 요긴하게 사용된다. |
|

삼산화 비소(왼쪽)와 삼산화 비소를 함유한 백혈병 치료제(오른쪽, 출처: Natco). 비상이라 불리는 삼산화 비소는 질병 치료에도 사용되었으며, 최근에는 급성골수성 백혈병 치료제로 허가되었다.
|
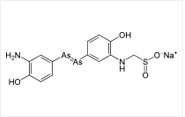
네오살바르산 (매독 치료제). |
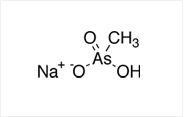
메틸 비산 소듐 (농약). |
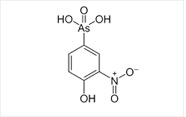
록사손 (양계용 사료 첨가제). |

아르세노베타인 |
|
|
|
|
파리스 그린이라 불린 아세토아비산 구리는 한때 살충제와 그림 물감으로 많이 사용되었다. <출처: (CC)Chris goulet at Wikipedia.org> |
마시 시험법을 수행하기 위한 기구. 비소 독극물로 희생된 사람의 생체시료를 아연과 묽은 황산으로 처리하면 비소화합물이 AsH3로 전환되고, 이 기체를 유리관에 모아 높은 온도로 가열해서 분해시키면 가열된 유리 위에 비소가 퇴적되는 것으로 비소의 존재를 알아낸다. |
|
|
|
|
|
|
- 수치로 보는 비소
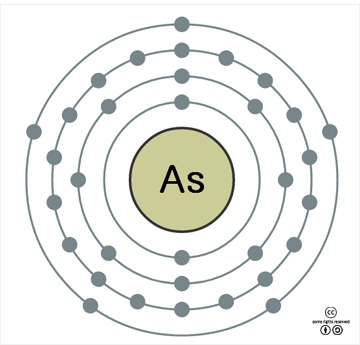
비소의 원자번호는 33이고 표준원자량은 74.922 g/mol이다. 원자의 바닥 상태 전자배치는 1s22s22p63s23p63d104s24p3 ([Ar]3d104s24p3)이며, 화합물에서 주된 상태 상태는 +5, +3, -3 이나, +2와 +1의 산화상태를 갖는 화합물들도 있다. 지각에서의 존재 비는 약 1.8 ppm (0.00018%)로 대략 51번째로 풍부한 원소이다. 2009년 기준 전 세계 생산량(As2O3 기준)은 54,400톤이고, 중국이 이의 약 46%인 25,000톤을 생산한다. 회색, 노란색, 검정색의 3가지 동소체가 있으며, 회색 비소(α-비소)가 가장 흔해서 특별한 언급이 없으면 이 동소체를 나타낸다. 1기압에서 승화점은 615oC, 38.6기압에서의 녹는점은 816oC, 20oC에서 밀도는 5.727g/cm3, 그리고 증발열은 31.9kJ/mol이다. 열 전도율은 50.2 W∙m-1∙K-1이고, 전기 비저항은 333 nΩ∙m이다. 첫 번째, 두 번째, 세 번째 이온화 에너지는 각각 947, 1798, 2735 kJ/mol이고, 폴링의 전기 음성도는 2.18이다. 원자 반경은 119 pm이고, As3+ 이온(6 배위체)의 반경은 58 pm, As5+ 이온의 반경은 46 pm이다. 천연 상태에서는 75As의 한가지 동위원소로만 존재한다.
발행일 2012.04.11
Arsenic
Atomic Weight
74.9216
Density
5.727 g/cm3
Melting Point
817 °C
Boiling Point
614 °C[note]
Full technical data
Arsenic was the poison of choice until its detection became easy. Combined with gallium it forms a semiconductor used in creating high-speed integrated circuits for supercomputers and cell phones.
Scroll down to see examples of Arsenic.
'Natural science > 화 학' 카테고리의 다른 글
| Bromine(Br), 35-브롬(브로민) (0) | 2012.06.21 |
|---|---|
| Selenium(Se), 34- 세레늄 (0) | 2012.06.21 |
| Germanium (Ge) - 32- 저마늄 (0) | 2012.06.21 |
| Gallium( Ga), 31- 갈륨 (0) | 2012.04.09 |
| Zinc(Zn), 30- 아연 (0) | 2012.04.09 |