|

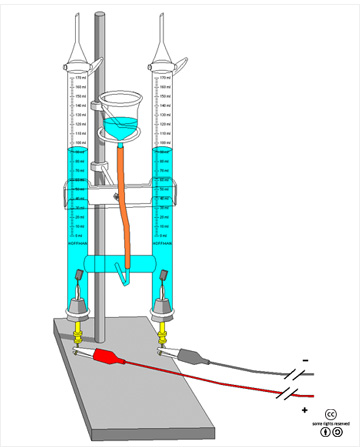
물을 전기분해하는 모습.
전기분해 반응의 특징

|
|
|
|
|
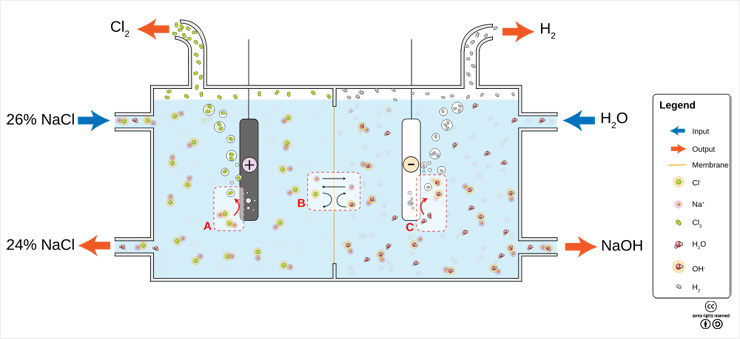
소금물의 전기분해 방법. 가운데 멤브레인이 설치되어 있고,
+극에서 염소 가스를 얻을 수 있다. <출처: (cc) Jkwchui at Wikipedia>
|
|

배터리를 충전하는 것도 전기분해이다. <출처: Gettyimage>
|
|
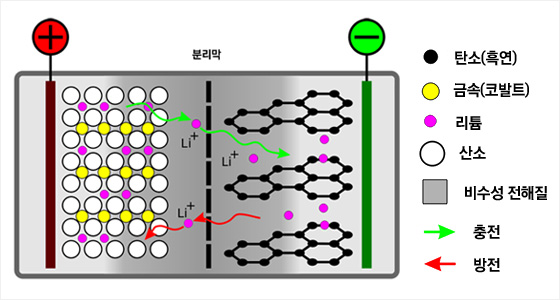
흑연을 –극으로, 리튬코발트산화물을 +극으로 사용하는 리튬이온전지 모식도.
|
|
발행일 2012.04.17
'Natural science > 화 학' 카테고리의 다른 글
| Reduction(환원반응) (0) | 2012.12.28 |
|---|---|
| 리튬이온전지 (0) | 2012.12.28 |
| Cathode & anode (0) | 2012.12.28 |
| Sugar(설탕) (0) | 2012.12.28 |
| MSG (0) | 2012.12.28 |