|
자연의 광합성
자연에서 일어나는 대표적인 환원 반응에는 식물에서 이산화탄소가 포도당으로 변하는 것이다. 포도당과 산소가 생성되는 광합성 반응은 결국은 이산화탄소가 환원되는 반응이며, 물이 산화되어 산소가 발생하는 산화반응도 동시에 진행된다.
6 CO2 + 6 H2O → C6H12O6 + 6 O2
산림이 파괴되어 광합성 반응이 덜 진행되면 환원되는 이산화탄소의 양이 줄어들게 되고, 그 결과 지구의 온난화도 가속화 될 것이다. 그러나 효율적인 촉매와 화학반응을 고안하여 이산화탄소를 효율적으로 환원시켜 연료(CH4, HCOOH 등)로, 더 나아가서 유사 석유를 만들어 내는 성과를 낸다면 미래의 에너지 문제도 해결할 수 있을 것이다. 화학이 더 발달하여 미래에 이산화탄소로부터 직접 자동차 연료를 얻는 꿈 같은 일도 불가능해 보이지 않는다.
CO2 + 2 H2O → CH4 + 2 O2
2 CO2 + 2 H2O → 2 HCOOH + O2
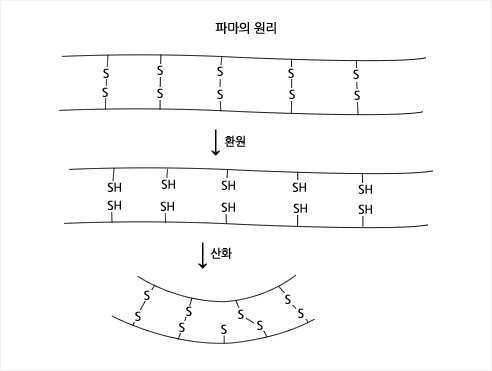
미용실의 파마
환원반응 후에 산화반응을 순차적으로 매일매일 진행하는 곳이 미용실이다. 파마는 이황화 화합물을 2개의 싸이올기(RSH)로 환원시키고 그 후에 싸이올 기를 다시 산화시켜서 이황화 화합물을 형성하는 반응을 이용하는 것이다. 머리카락은 케라틴(keratin) 단백질이 주 성분이며, 단백질 사슬들 사이에는 이황화(RS-SR) 결합으로 서로 연결되어 있다. 환원과정에 사용되는 화학물질(ammonium thioglycolate: ZSH) 역시 황을 포함하고 있어 특유의 냄새가 난다. 미용실에서 풍기는 독특한 냄새에도 이 화합물의 기여도가 적지 않을 것이다.
RS–SR + 2 ZSH → 2 RSH (환원) + ZS–SZ
2 RSH + H2O2 → RS-SR (산화) + 2H2O
머리카락을 롯드(rod)로 감았기 때문에 환원 반응으로 형성된 수 많은 싸이올 기의 위치는 본래의 이황화 결합이 끊어졌던 위치에 그대로 있지 않다. 그러므로 새롭게 형성되는 이황화 결합의 위치와 본래의 이황화 결합의 위치는 다르며, 이황화 결합에 사용되는 싸이올기 2개도 본래의 짝과는 다르다. 환원되고 동시에 위치에 변동이 생기게 끔 싸이올 기들을 형성하는 것이 파마의 첫 번째 과정이며, 산화제(H2O2)를 사용하여 새로운 위치에 새로운 이황화 결합을 형성하는 것이 파마의 두 번째 과정인 것이다. |