|
|
|
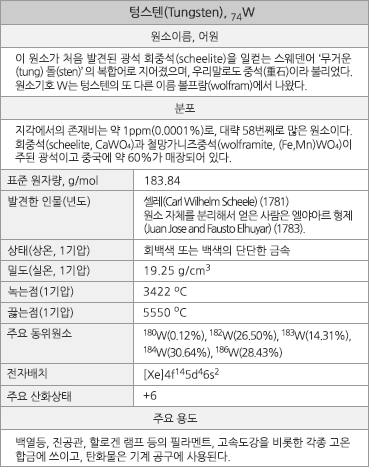
원자번호 74번 텅스텐 <출처: (cc) Arnoldius at wikimedia.org> |
텅스텐의 원소정보 |
|
|

대표적인 텅스텐 광석인 회중석(scheelite)(왼쪽)과 철망가니즈중석(wolframite)(오른쪽). 텅스텐은 회중석을 일컫는 스웨덴어 무거운(tung) 돌(sten)에서 따왔고, 원소 기호 W는 철망가니즈중석에서 따온 텅스텐의 또 다른 이름 볼프람(wolfram)에서 나왔다. <출처: (cc)Alchemist-hp at de.wikipedia(좌), Didier Descouens (우)>
|

텅스텐 금속. 텅스텐은 회백색 또는 백색의 단단하고 무거운 금속으로, 금속 중에서 녹는점이 가장 높고 증기압이 가장 낮다. 사진은 텅스텐 봉과 텅스텐 알갱이임. <출처: (cc) W. Oelen, USGS>
|
|
|
|
|

텅스텐은 백열전구 등의 필라멘트로 사용된다.
|

탄화텅스텐으로 만든 드릴 비트
|

탄화텅스텐 반지. 탄화텅스텐은 잘 마모되지 않아 장신구에 널리 사용되며, 텅스텐은 금과 밀도가 아주 비슷하여 가끔 위조 금으로 사용되기도 한다. <출처: (cc) SolitaryAngel at Wikimedia.org>
|

텅스텐은 흔히 (왼쪽)삼산화텅스텐(WO3)과 (오른쪽)파라텅스텐산암모늄(APT,(NH4)10W12O41·5H2O)으로 제조되어 판매된다. APT는 가열하면 분해되어 WO3가 되고, WO3를 수소 또는 탄소 환원시키면 텅스텐 분말이 얻어진다.
|
|
 수치로 보는 텅스텐
수치로 보는 텅스텐
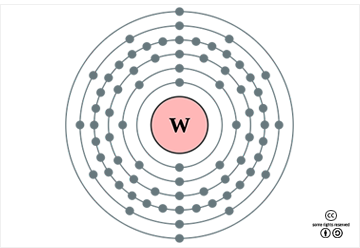
텅스텐의 표준원자량은 183.84g/mol이고, 원자의 바닥 상태 전자배치는 1s22s22p63s23p63d104s24p64d105s25p64f145d46s2([Xe]4f145d46s2)이며, 화합물에서 주된 산화 수는 +6이나, -2~+5가 상태의 여러 화합물들도 있다. 지각에서의 존재 비는 약 1ppm(0.0001%)으로, 대략 58번째로 풍부한 원소이다. 1기압에서 녹는점은 금속 원소 중에서 가장 높은 3422oC이고 끓는점은 5550oC이며, 25oC에서의 밀도는 19.25g/cm3(비교: 금, 19.30g/cm3)이고 녹는점에서의 액체 밀도는 17.62g/cm3이다. 녹음열과 증발열은 각각 35.3 kJ/mol과 806.7 kJ/mol이다, 20oC에서의 전기비저항은 52.8 nΩ·m(비교: 금, 23.5 nΩ·m)이다. 첫 번째와 두 번째 이온화 에너지는 각각 770과 1700 kJ/mol이며, 폴링의 전기 음성도는 대략 2.36이다. 원자 반경은 139pm(비교: Mo, 139pm)이고, 6배위체의 W6+ 이온 반경은 60pm(비교: Mo6+, 59pm)이다. 천연상태 동위원소는 180W(0.12%), 182W(26.50%), 183W(14.31%), 184W(30.64%), 186W(28.43%)의 5가지이다. 2011년의 전세계(미국제외) 연간 생산량은 약 72,000톤이고. 이의 83%가 중국에서 생산된다. 전세계 광석 매장량은 약 310만 톤으로 추정된다.
발행일 2013.02.20
Tungsten
Tungsten is extremely hard to melt, so when large pieces are needed it is often sintered into solid form from loose powder, like this cube. The biggest application by far is tungsten wire for incandescent light bulbs. Scroll down to see examples of Tungsten | |||||||||||||||||
'Natural science > 화 학' 카테고리의 다른 글
| Osmiun(Os), 76-오스뮴 (0) | 2013.03.13 |
|---|---|
| Rhenium(Re), 75-레늄 (0) | 2013.03.13 |
| Tantalum(Ta), 73-탄탈럼 (0) | 2013.02.13 |
| Hafnium(Hf), 72-하프늄 (0) | 2013.02.13 |
| Lutetium(Lu), 71-루테튬 (0) | 2013.01.23 |