|
화학에서 관심이 있는 많은 변화는 부피가 일정한 상태보다는 압력이 일정한 상태, 즉 대기압 아래에서 일어나는 경우가 많다. 대기압 아래에서 일어나는 물의 증발, 얼음의 융해, 연료의 연소 반응이
그 예라 할 수 있다. 우리 주변에서 흔히 볼 수 있는 이런 물리-화학적 변화에서 일어나는 열의 출입을 좀 더 간단히 취급하기 위해서는
에너지보다 편리한 새로운 함수를 도입할 필요가 있다.
엔탈피 변화량은 일정한 압력 하에서 계가 받은 열량

일정한 압력 아래에서 일어나는 물리∙화학적 변화에서 출입하는 열량을 알기 위해, 19세기 중반에 엔탈피가 도입되었다. 엔탈피(H)는
에너지(E)에 압력(P)과 부피(V)의 곱을 더한 것으로 정의한다.

따라서 엔탈피 변화량 ΔH는 ΔH = ΔE+ Δ(PV)라 할 수 있다. Δ(PV)는 (PΔV + VΔP)로 쓸 수 있고, P-V 일 이외의
다른 일이 관여하지 않는다면, ΔE = Q - PΔV 이므로, 이 경우 ΔH는 다음과 같이 된다.
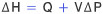
따라서 일정한 압력(ΔP = 0) 하에서 일어나는 물리∙화학적 변화에서 흡수한 열량(QP)은 엔탈피 변화(ΔH)와
같다.
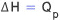
발열 반응에서는 엔탈피가 감소하고,
흡열 반응에서는 엔탈피가 증가한다

흔히 화학에서는 반응을 흡열반응과 발열반응으로 구분한다. 흡열반응은 반응에 의해 온도가 낮아지는 경우이다. 소금을 물에 녹이면 온도가 약간
내려가는 것이 이의 예이다. 이는 반응 후의 온도를 반응 전의 처음 온도와 같게 하기 위해서는 주위에서 열을 흡수해야 함을 의미한다. 따라서
QP>0 이므로 엔탈피는 증가한다.
이와 반대로, 발열반응은 물과 황산을 섞을 때나 연료가 탈 때처럼 반응에 의해 계의 온도가 올라가는 경우이다. 이때는 반응 후의 온도를
반응 전과 같게 하기 위해서 열을 방출시켜야 한다. 즉 QP<0 가 되고, 따라서 엔탈피는 감소한다. 즉 흡열
반응에서는 엔탈피가 증가하고, 발열 반응에서는 엔탈피가
감소한다. | 




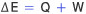

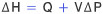
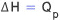
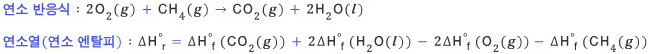
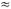 ΔE가 된다. 이 때문에 부피의
변화가 크지 않은 고체나 액체만을 포함하는 반응에서는 엔탈피와 에너지를 엄격하게 구분하지 않고 사용하기도 한다. 반응에서 기체의 몰 수가 변화는
경우에 Δ(PV)는
ΔE가 된다. 이 때문에 부피의
변화가 크지 않은 고체나 액체만을 포함하는 반응에서는 엔탈피와 에너지를 엄격하게 구분하지 않고 사용하기도 한다. 반응에서 기체의 몰 수가 변화는
경우에 Δ(PV)는 