
원자번호 107번의 원소 보륨(bohrium, Bh)은 열다섯 번째 초우라늄 원소이고 네 번째 초악티늄족 원소(transactinide element)인데, 주기율표에서 7주기 7족에 있는 전이금속 원소이다. 원소 이름은 원자 구조를 처음으로 바르게 설명하고 원자 구조와 양자 이론을 결합시킨 덴마크 물리학자 닐스 보어(Niels Bohr)의 이름을 따서 지었다. 원소의 영어 이름이 원자번호 5번의 붕소(Boron, B), 56번의 바륨(Barium, Ba)과 비슷해서 혼동하기 쉬우므로 주의가 필요하다. 보륨은 1981년에 독일 다름슈타트(Darmstadt)에 있는 중이온 가속기연구소(GSI)의 연구진이 처음으로 합성·발견한 것으로 인정되고 있다. 원자번호 106번까지의 초우라늄(인공) 원소들이 모두 미국 로렌스버클리 국립연구소(LBL) 또는 러시아의 합동핵연구소(JINR)에서 처음 발견되었는데, 이 원소는 처음으로 미국과 러시아가 아닌 나라에서 발견된 초우라늄 원소이다. 1969년에 설립된 독일 중이온 가속기연구소는 1975년에 매우 정교한 가속기와 원소 분리 및 검출 장치가 제작·설치되었는데, 이곳 연구진들은 이 장치를 사용하여 이 원소 외에도 다른 5가지 초악티늄족 원소들을 단독 또는 공동으로 발견하였다. 이 연구소는 또한 가속된 중이온 빔(beam)을 물리학, 생물리학, 암 치료 등의 의학 분야 연구에 이용하고 있다. 우리나라는 이제야 2017년 완공을 목표로 중이온 가속기 구축을 추진하고 있다. 보륨은 한번에 원자 몇 개만 얻어지며 가장 안정한 동위원소의 반감기가 약 61초에 불과한 아주 수명이 짧은 방사성 원소로, 일반적인 물리 및 화학적 특성은 잘 알려져 있지 않다. 화학적 성질은 주기율표에서 바로 위에 있는 레늄(Re)과 비슷한 것으로 여겨진다. 보륨의 발견, 특성, 합성 등에 대해 보다 자세히 알아보기로 하자.
원자번호 107번, 보륨
보륨(bohrium)1)은 원자번호 107번의 원소로, 원소 기호는 Bh이다. 주기율표에서 d-구역의 초악티늄 원소의 하나이며, 7주기 7족(7B족)에 있는 전이금속 원소이다. 7족 원소로는 망가니즈(Mn), 테크네튬(Tc), 레늄(Re)도 있는데, 보륨은 레늄 바로 아래에 있으므로 에카-레늄(eka-rhenium)이라 부를 수 있다.
- 수치로 보는 보륨
- 보륨 원자의 바닥상태 전자배치는 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p65f146d57s2([Rn]5f146d57s2)로 예상된다. 질량수가 260~262, 264~267, 270~272, 274인 11가지 동위원소가 알려져 있는데, 반감기가 가장 긴 것은 270Bh(반감기 61초)이다. 그러나 아직 미발견된 273Bh와 275Bh의 반감기가 각각 약 90분과 약 40분으로, 이보다 더 길 것으로 예상된다. 녹는점과 끓는점은 알려져 있지 않으며, 밀도는 37 g/cm3으로 예측되었다. 첫 번째, 두 번째, 세 번째 이온화 에너지는 각각 742.9, 1688.5, 2566.5 kJ/mol로 추정되었다. 주된 산화상태는 +7이나, +5, +4, +3의 산화상태도 가능할 것이 예상된다. 원자의 반경은 128 pm로 예상된다.

덴마크 물리학자 닐스 보어(Niels Bohr)를 기리는 원소. |
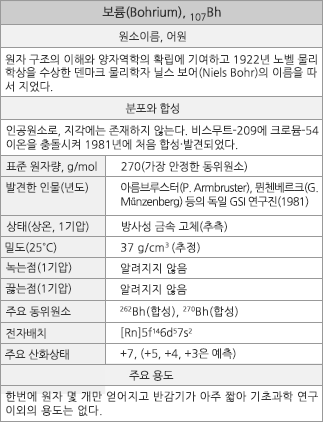
보륨의 원소정보 |
보륨은 인공 방사성 원소로 자연에는 존재하지 않으며, 입자 가속기를 사용하여 보다 가벼운 원소 표적에 중(重)이온을 충돌시켜 얻거나, 보다 원자번호가 큰 원소의 α 붕괴 사슬에서 얻는다. 1976년에 러시아(구 소련)의 합동핵연구소(Joint institute for Nuclear Research, JINR)에서 비스무트-209(209Bi)에 크로뮴-54(54Cr) 이온을 충돌시켜 261Bh를 처음 합성하였다고 발표하였으나, 검증되지 않아 그 주장이 인정되지 않았다. 그 후, 1981년에 독일 중이온 가속기연구소(Gesellschaft fűr Schwerionenforschung, GSI) 팀이 한층 정교한 기술을 사용하여 러시아 팀이 이용한 것과 같은 반응에서 262Bh를 검출하였는데, 이것이 보륨의 최초 발견으로 인정되고 있다. 지금까지 11가지 동위원소가 알려져 있으며, 반감기가 가장 긴 것은 270Bh(반감기 약 61초)인데, 아직 발견되지 않은 273Bh와 275Bh의 반감기가 각각 90분과 40분으로 이보다 길 것으로 예측되었디.
보륨은 한번에 단지 원자 몇 개만 만들어지고 또 반감기가 아주 짧아, 물리∙화학적 특성은 잘 알려져 있지 않다. 표준상태에서 은색 금속 고체이고, 공기, 수증기, 산과 잘 반응할 것으로 예측되었다. 밀도는 37 g/cm3으로 예측되며, 녹는점과 끓는점은 알려져 있지 않다. 화학적 성질은 레늄(Re)과 비슷하며, 주된 산화상태는 +7이고, +5, +4, +3 의 산화상태도 가능할 것으로 여겨진다. 산소와 반응하여 휘발성인 칠산화보륨 (Bh2O7)을 만들 것이 예상된다. 극히 부분적인 화학적 연구가 기체상에서 수행되었는데, 산소(O2)와 염화수소(HCl)와 반응하여 휘발성인 옥시산화물 BhO3Cl를 만든다는 증거가 얻어졌다.
보륨의 발견과 역사
107번 원소 보륨의 발견에 대한 최초의 보고는 1976년에 러시아(구 소련) 두브나(Dubna)에 있는 합동핵연구소(JINR)의 오가네시안(Yuri Organessian, 1933~) 연구팀에 의해 이루어졌다. 오가네시안은 JINR의 플레로프 핵반응연구소(Flerov Laboratory of Nuclear Reactions, FLNR)를 1957년에 설립하고 30년간 소장 직을 맡아 여러 초페르뮴 원소들의 합성과 발견을 주도해온 플레로프(Georgy Flerov, 1913~1990)의 연구원이었으며, 이후 플레로프를 이어 10년간 FLNR의 소장 직을 맡아 새로운 원소의 합성과 발견을 이끈 인물이다. 이 연구팀은 비스무트-209(209Bi) 표적에 가속된 크로뮴-54(54Cr) 이온을 충돌시켜 자발적 핵분열을 하는 질량수가 261인 107번 원소(현재의 표기로 261Bh)를 검출하였다고 보고하였다. 그러나 후속 연구에서 261Bh가 아주 낮은 분율(지금 알려진 것은 약 5%)로만 자발적 핵분열을 하는 것이 밝혀지고 그들의 주장은 오류에 의한 것으로 여겨져 러시아 팀은 보륨의 최초 발견자로 인정되지 않고 있다.

독일 다름슈타트에 있는 중이온 가속기연구소(GSI)의 조감도. 처음으로 미국과 러시아 이외의 나라에서 초우라늄 원소를 발견한 곳이다. <출처 : GSI>
신빙성이 있고 공식적인 107번 원소의 합성과 발견은 1981년에 독일 다름슈타트(Darmstadt)에 있는 중이온 가속기연구소(GSI)의 아름브루스터(Peter Armbruster, 1931~)와 뮌첸베르크(Gottfried. Műnzenberg, 1940~)가 이끄는 연구진에 의해 이루어졌다. 그들은 러시아 팀과 마찬가지로 209Bi 표적에 가속된 54Cr 이온을 충돌시켜 질량수 262인 보륨(262Bh) 원자 5개를 확인하였다고 보고하였다.

GSI는 1967년에 중이온 가속기를 설치하고 초중(超重)원소(super-heavy element)의 화학과 물리학을 연구하기 위해 설립되었다. 이 연구소에서는 초중원소의 합성과 검출에 여러 정교한 새로운 기술들이 사용되었는데, 하나는 수소에서 우라늄까지의 이온들을 가속할 수 있는 중이온 범용 선형가속기(Universal Linear Accelerator, UNILAC)이고, 다른 하나는 중이온이 충돌한 표적에서 반동으로 튀어나오는 생성물 원자를 효과적으로 분리해내는 ‘중이온 반응 생성물 분리기(Separator for Heavy-Ion reaction Products, SHIP)’이다. 이 연구소 연구진은 이런 기술을 이용하여 지금까지 원자번호 107(보륨)에서 112(코페르니슘)까지의 6가지 새로운 원소들을 합성∙발견하였다.
|
1  |
2  |
|
1 독일 중이온 가속기연구소에 설치된 범용 선형가속기(UNILAC)의 내부. 이를 이용하여 보륨을 비롯한 6 가지 초우라늄 원소들이 합성·발견되었다. 또한, 이곳에서는 가속된 중이온 빔(beam)을 물리학, 생물리학, 암 치료 등의 의학 분야 연구에 활용하는 각종 연구가 수행된다. 2 중이온이 충돌한 표적에서 반동으로 튀어나오는 생성물 원자를 효과적으로 분리해내는 ‘중이온 반응 생성물 분리기(Separator for Heavy-Ion reaction Products, SHIP)’의 일부 |
원소 이름에 대한 제안과 결정
독일 GSI 팀은 107번 원소의 이름을 원자 구조의 이해와 양자역학의 확립에 기여하고 1922년 노벨물리학상을 수상한 덴마크 물리학자 닐스 보어(Niels Bohr, 1885~1962)를 기리기 위해 그의 이름을 따서 닐스보륨(nielsbohrium)으로, 원소기호는 Ns로 할 것을 제안하였다. 그런데 닐스보륨이란 원소 이름은 소련 JINR 팀이 이미 105번 원소(현재의 이름은 더브늄)의 이름으로 제안한 것이었다. 국제순수·응용화학연맹(IUPAC)은 GSI 팀이 보다 신뢰할 수 있는 자료를 제출하였으므로 107번 원소의 발견에 대한 공적을 인정받아야 하나, JINR 팀이 먼저 발견하였을 가능성도 있으므로 양 팀이 상호 협의하여 원소 이름을 제안할 것을 종용하였다. 그리고 잠정적으로 원자번호에 따른 계통적 명명법을 적용하여 운닐셉튬(unnilseptium, Uns)이란 이름을 채택하였는데, 이는 1, 0, 7에 해당하는 라틴어를 조합하여 만든 것이다. JINR 팀은 GSI 팀이 제안한 닐스보륨에 동의하였는데, IUPAC은 1994년에 사람의 이름(first name)과 성(last name)을 모두 따서 지은 원소 이름은 전례가 없다는 이유로 성(last name)만 딴 보륨(bohrium)을 추천하였다. 독일 GSI 팀은 보륨이란 이름이 5번 원소 붕소(boron)와 혼동(특히 산소산 염의 경우 영어로 각각 bohrate와 borate가 됨)될 우려가 있다고 반대하였으나, 덴마크 화학자들이 보륨 ‘bohrium’을 선호하여 1997년에 이 이름으로 최종 결정되었다. 단, 혼동을 피하기 위해 보륨의 산소산 염은 ‘bohrate’ 대신에 ‘bohriate’로 하기로 결정하였다. 우리말로는 각각 보륨과 붕소, 그리고 보륨산과 붕소산으로 명확히 구분되나, 영어로 적을 때는 주의가 필요하다.
물리적 성질
보륨은 모든 동위원소가 반감기가 아주 짧은 인공 원소이고, 한번에 원자 몇 개만 얻어지므로 물리 및 화학적 특성들은 거의 알려져 있지 않다. 상온에서 은색 고체 금속이고, 결정은 육방밀집(hcp) 구조를 할 것으로 예상된다. 녹는점과 끓는점은 알려지지 않았으며, 앞으로도 측정될 가능성이 거의 없다. 밀도는 약 37 g/cm3, 원자 반경은 약 128 pm로 예측되었다.
동위원소와 방사성 붕괴 성질
지금까지 알려진 보륨의 동위원소는 질량수가 260~262, 264~267, 270~272, 274인 11가지이며, 핵 이성질체는 262mBh가 알려져 있다. 이중에서 264Bh와 질량수 270 이상인 동위원소들은 직접 합성되지는 않았으며, 보다 원자번호가 큰 원소들의 α 붕괴 사슬에서 발견되었다. 반감기가 가장 긴 동위원소는 270Bh(반감기 61초)이며, 반감기가 1초 이상인 동위원소들은 270Bh 이외에 274Bh(반감기 약 54초), 267Bh(반감기 약 20초), 272Bh(반감기 약 9초), 271Bh(반감기 1.2초)이다. 아직 발견되지 않은 동위원소 273Bh와 275Bh의 반감기가 각각 약 90분과 약 40분으로, 이들보다 길 것으로 예측되었다. 참고로, 보륨 동위원소들의 반감기는 검출된 단지 몇 개의 원자들의 수명을 측정해서 계산된 것이므로 불확실성이 크며, 이런 점은 다른 초악티늄족 원소들에서도 마찬가지이다. 대부분의 보륨 동위원소들은 거의 전적으로 α 붕괴를 하고 더브늄(Db) 동위원소가 된다. 다만 261Bh, 262Bh, 262mBh, 264Bh는 일부가 자발적 핵분열을 하기도 하는데, 그 비율은 30% 미만이다.
화학적 성질
보륨은 7족 원소로, 주기율표에서 레늄(Re) 바로 아래에 있다. 따라서 이의 화학적 성질은 레늄과 가장 비슷할 것으로 예상된다. 주된 산화상태는 +7이나, +5, +4, +3의 산화상태도 가능할 것으로 예상된다. 산소와 반응하여 휘발성인 칠산화보륨(Bh2O7)을 생성하며, 이 산화물은 물에 녹아 과보륨산(perbohric acid, HBhO4 또는 Bh2O7∙2H2O)을 생성할 것이 예상된다. 화학적 성질에 대한 실험적 연구가 극히 일부 수행되었는데, 2000년에 스위스의 폴쉐르 연구소(Paul Scherrer Institute, PSI) 연구진은 버클륨-249(249Bk) 표적에 네온-22(22Ne) 이온을 충돌시켜 267Bh(반감기 약 20초) 원자를 생성시키고, 이를 산소(O2)와 염화수소(HCl) 기체에 통과시킨 후 생성물을 온-라인 기체 크로마토그래피로 분리하여 옥시염화레늄(ReO3Cl, 끓는점 131℃)과 성질이 비슷한 휘발성 옥시염화보륨 BhO3Cl이 생성되었다는 증거를 얻었다.
2 Bh + 3 O2 + 2 HCl → 2 BhO3Cl + H2
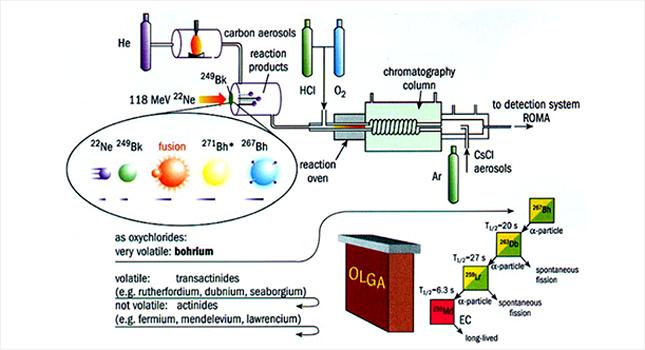
스위스 폴쉐르 연구소(PSI)에서 보륨의 화학적 성질을 연구하는데 사용한 실험 장치의 모형도. 249Bk 표적에 가속된 22Ne을 충돌시켜 267Bh를 생성하고, 이를 산소(O2)와 염화수소(HCl) 기체와 반응시켜 옥시염화물로 전환시킨 후 분리, 검출하는 각 단계를 보여준다. 보륨은 옥시염화물의 휘발성이 크기 때문에 온-라인 기체 크로마토그래피 장치(OLGA)에서 분리될 수 있고, 이의 존재는 방사성 붕괴 사슬에서 나오는 방사선을 회전 휠 다중검출 분석기(rotating wheel multidetector analyzer, ROMA)로 검출함으로써 확인된다. 보륨과 다른 초악티늄족 원소, 그리고 악티늄족 원소의 옥시염화물의 휘발성이 비교되어 있으며, 267Bh의 α 붕괴 사슬도 보여준다.
보륨의 합성
보륨과 같은 초중(超重)원소들은 입자가속기를 사용하여 원소 또는 화합물 상태의 표적에 중(重)이온을 충돌시켜 합성된다. 이때 표적 원소와 충돌하는 이온은 이들의 원자번호의 합이 합성하고자 하는 원소의 원자번호와 같은 것을 선택한다. 보륨의 합성에는 납(Pb) 또는 비스무트(Bi)를 표적으로 사용하는 콜드퓨전(cold fusion)과 가벼운 악티늄족 원소를 표적으로 사용하는 핫퓨전 방법이 모두 사용된다. 보륨은 또한 원자번호가 보다 큰(그리고 홀수인) 초중원소의 α 붕괴 사슬에서도 발견된다. 보륨 동위원소는 자체의 방사성 붕괴(주로 α 붕괴)와 이에 의해 생성된 딸 원자핵의 붕괴 생성물의 시간적 상관 관계에서 검출되고 확인된다. 가끔은 보륨을 휘발성 화합물로 전환시킨 후 기체 크로마토그래피 방법으로 분리하고 이의 방사성 붕괴 생성물을 검출하는 방법이 사용되기도 한다.
독일의 중이온 가속기연구소(GSI), 러시아의 합동핵연구소(JINR)의 플레로프 핵반응연구실(FLNR), 미국의 로렌스버클리 국립연구소(LBL), 스위스의 폴쉐르 연구소(PSI) 등에서 주로 연구되고 합성되었다.

독일 중이온 가속기연구소에 설치된 범용 선형가속기(UNILAC)의 외부. 이를 이용하여 보륨을 비롯한 6 가지 초우라늄 원소들이 합성·발견되었다
콜드퓨전
콜드퓨전에서는 83Bi 또는 82Pb 표적에 각각 24Cr, 25Mn 이온을 충돌시켜 합성하였다. 표적과 충돌하는 이온이 융합되어 생성된 들뜬 상태의 107Bh 핵은 1~2 개의 중성자를 방출하면서 바닥 상태로 붕괴한다. 보륨 생성이 확인된 콜드퓨전 반응들은 다음과 같다.
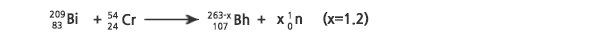
위 반응은 1976년에 러시아 JINR 연구팀이 처음 연구한 반응인데, 그들은 반감기가 각각 1~2 밀리초(ms, 1ms=1/1000초)와 5초로 자발적 핵분열을 하는 생성물을 검출하고는 이들을 261Bh와 이의 α 붕괴 생성물인 257Db에 의한 것으로 해석하였다가, 뒤에 258Db와 258Rf에 의한 것으로 변경하였다. 이 경우 생성된 보륨은 262Bh가 되며, 262Bh는 α 붕괴로 258Db가 되고, 258Db가 β+ 또는 전자포획을 하면 258Rf가 된다.

독일의 GSI 연구팀은 1981년에 위의 209Bi와 54Cr 간의 반응을 다시 조사하고 모핵과 딸핵의 상관관계 방법으로 262Bh 원자 5개를 검출하였으며, 1989년에는 261Bh도 검출하였다. 2003년에는 표적으로 209Bi 금속박 대신 209BiF3를 사용한 실험에서 262Bh와 이의 딸 원자 258Db를 검출하였다. 또 LBL 연구팀은 2003년에 262Bh 원자 15개와 261Bh 원자 3개를 검출하고, 262Bh의 핵 이성질체 262mBh를 확인하였다.

위 반응은 2007년에 LBL 연구팀이 수행하였는데, α 붕괴를 하고 256Db로 전환되는 260Bh 원자 5개를 검출하였다.
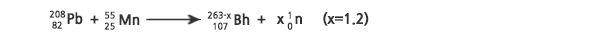
위 반응은 1976년에 러시아 JINR 팀이 처음 연구하였는데, 앞에서 언급한 209Bi와 54Cr 사이의 반응에서와 마찬가지로 2가지의 자발적 핵분열을 하는 생성물을 검출하고는 이를 동일하게 해석하였다. 이들은 1983년에 이 실험을 반복하여 262Bh의 붕괴 생성물에서 나오는 α 입자를 검출하였다. LBL 팀은 2005년에 이 반응의 생성물에서 262Bh 원자 33개와 261Bh 원자 2개의 붕괴를 관찰하였다.
핫퓨전
핫퓨전에서는 가벼운 악티늄족 원소인 95Am, 96Cm, 또는 97Bk 표적에 중이온을 충돌시켜 합성하였다. 보륨 동위원소의 생성이 확인된 반응들은 다음과 같다.
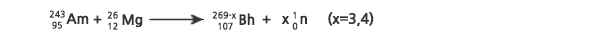
위 반응은 2004년에 중국의 현대물리연구소(IMP)에서 연구하였는데, 처음으로 265Bh를 발견하였으며, 266Bh의 생성도 확인되었다.

위 반응은 2008년에 일본 이화학연구소(RIKEN)에서 처음으로 연구하였는데, 2010년에 9.05~9.23 MeV α 입자를 방출하는 266Bh의 붕괴를 확인하였다.
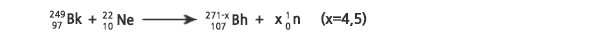
위 반응은 1979년과 1983년에 러시아 JINR 연구진이 연구하였는데, 그들은 자발적 핵분열을 하는 생성물을 검출하지 못하였다. 1999년에 미국의 LBL 연구진은 이 반응에서 266Bh 원자 1개와 267Bh 원자 5개를 검출하였다. 2000년에 스위스 PSI 연구진은 이 반응으로 267Bh 원자 6개를 얻었으며, 이를 사용하여 보륨의 화학적 성질을 조사하였다,
이외에 238U 표적에 31P 이온을 충돌시키는 실험이 2006년에 LBL 연구진에 의해 수행되었는데, 264Bh에 의한 것으로 여겨지는 자발적 핵분열이 관찰되었다.
보다 무거운 원소의 붕괴 생성물로 얻는 경우
보륨은 보다 원자번호가 큰 원소들의 α 붕괴 생성물로도 발견되는데, 예로 원자번호 109번 마이트너륨(meitnerium, Mt), 111번 뢴트겐늄(roentgenium, Rg), 113번 우눈트륨(ununtrium, Uut), 115번 우눈펜튬(ununpentium, Uup), 117번 우눈셉튬(ununseptium, Uus)의 각각 한 번, 두 번, 세 번, 네 번, 다섯 번의 α 붕괴 생성물로 검출된다. 특히 264Bh는 272Rg, 270Bh는 282Uut, 271Bh과 272Bh는 각각 287Uup와 288Uup, 그리고 274Bh는 294Uus의 연속적인 α 붕괴 생성물로 처음 발견되었다.

- 글
- 박준우 이화여대 명예교수(화학)
- 서울대학교 화학과를 졸업하고 템플대학교에서 박사학위를 받았다. 오랫동안 이화여대에서 화학을 연구하고 가르쳤다. 저서로 [인간과 사회와 함께한 과학기술 발전의 발자취]와 [아나스타스가 들려주는 녹색화학 이야기] 등이 있고, 역서로 [젊은 과학도에 드리는 조언] 등이 있다.
- 저자의 책 보러가기인물정보 더보기
주석
- 1수치로 보는 보륨
- 보륨 원자의 바닥상태 전자배치는 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p65f146d57s2([Rn]5f146d57s2)로 예상된다. 질량수가 260~262, 264~267, 270~272, 274인 11가지 동위원소가 알려져 있는데, 반감기가 가장 긴 것은 270Bh(반감기 61초)이다. 그러나 아직 미발견된 273Bh와 275Bh의 반감기가 각각 약 90분과 약 40분으로, 이보다 더 길 것으로 예상된다. 녹는점과 끓는점은 알려져 있지 않으며, 밀도는 37 g/cm3으로 예측되었다. 첫 번째, 두 번째, 세 번째 이온화 에너지는 각각 742.9, 1688.5, 2566.5 kJ/mol로 추정되었다. 주된 산화상태는 +7이나, +5, +4, +3의 산화상태도 가능할 것이 예상된다. 원자의 반경은 128 pm로 예상된다.
Bohrium
Bohrium is not boring, it's just named after Niels Bohr, who figured out the electron structure of atoms and thus explained the periodic table. (OK, bohrium, with a half-life under half a second, actually is boring.) Scroll down to see examples of Bohrium. | |||||||||||||||||
'Natural science > 화 학' 카테고리의 다른 글
| Meitnerium(Mt), 109-마이트너륨 (0) | 2014.07.05 |
|---|---|
| Hassium(Hs), 108-하슘 (0) | 2014.07.05 |
| Seaborgium(Sg), 106-시보귬 (0) | 2014.07.05 |
| Dubnium(Db), 105-더브늄 (0) | 2014.07.05 |
| Rutherfordium(Rf), 104-러더포듐 (0) | 2014.07.05 |