|
2차전지 = 충전하여 다시 사용할 수 있는 전지

전지는 자발적인 화학반응으로 생성되는 에너지를 전기에너지로 이용할 수 있도록 고안된 장치이다. 자발적인 화학반응이 진행될 때 전지는 방전(discharge)된다고 표현한다. 1차전지(primary battery)는 완전 방전된 후에는 다시 사용할 수 없어서 버린다. 그러나 2차전지(secondary battery)는 충전(charge)을 해서 다시 사용할 수 있다. 충전이란 전기에너지를 전지에 주입하여 방전할 때 일어나는 화학반응을 역으로 진행시키는 작업이다. 따라서 충전이 완료된 전지내부에는 자발적인 화학반응을 일으킬 준비가 완료된 화학물질이 들어있다.
리튬 이온 2차전지의 구성

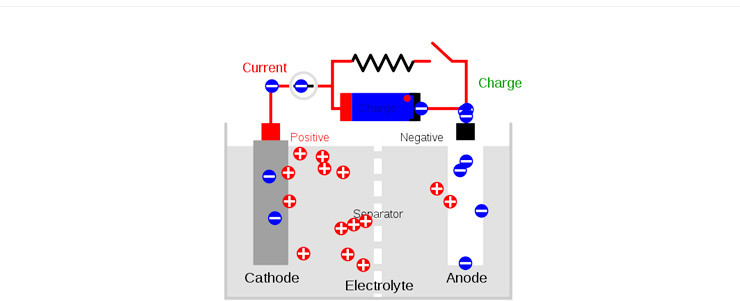
리튬 이온 전지 역시 다른 전지와 마찬가지로 2개의 전극(+, -극), 분리막, 전해질로 구성되어 있다. +극으로 이용되는 전극물질은 리튬 이온이 쉽게 들락거릴 수 있는 공간을 포함하는 결정 구조(crystal structure)를 지녀야 되고, 산화와 환원이 될 수 있는 금속 이온이 포함되어 있는 특징을 가지고 있다. 금속이온이 포함된 산화물, 인산염 들이 +극에 알맞은 특징을 지니고 있다. 대표적인 +극으로 사용되는 물질로는 리튬코발트산화물(LiCoO2), 리튬철인산염(LiFePO4), 리튬망간산화물(LiMn2O4) 등이 있다. 성질이 다른 금속이온을 첨가하여 만든 복합물질들이 순수한 물질보다 전지의 성능이 우수하다는 연구결과들이 계속 발표되고 있다.
-극으로 이용되는 전극물질은 금속 리튬, 흑연(graphite)등이 있다. 또한 리튬티탄(lithium-titanate) 결정, 실리콘-흑연 복합물(composite)을 –극으로 사용한 전지들이 개발되기도 하였다. 리튬 금속을 –극으로 사용하면 충/방전을 반복할 때 본래의 전극 모양을 유지하기 힘들고, 그 결과 +극과 접촉이 되면 전지가 망가진다. 흑연 혹은 결정 격자를 가진 물질을 이용하여 이런 문제를 해결하기도 한다. 충전할 때 결정격자 내에 금속 리튬을 석출하면 –극의 전극 모양을 유지할 수 있고 +극과의 접촉으로 인한 전지 파괴 문제도 해결할 수 있기 때문이다. 또한 나노 크기의 결정을 이용하면 전극면적을 넓히면 충방전의 속도 증가, 에너지 밀도의 상승과 같은 효과가 나타난다. 그렇지만 전극물질이 달라지면, 충방전 속도도 달라지고, 전압과 용량이 변할 수 있다.
전지 내부에는 2개의 전극 외에도 전해질(electrolyte)과 분리막(separator)이 있다. 전해질은 리튬 이온 염(예: LiPF6)을 물이 전혀 없는 유기용매에 녹인 것을 사용한다. 전해질에 물이 있다면 리튬 금속과 폭발적인 반응이 일어나므로 전지를 사용하기도 전에 망가진다. 또, 전기가 통하지 않는 고분자 분리막으로 +극과 -극이 직접 접촉이 되는 일을 막는다. 만약에 분리막이 없으면 +극과 -극이 직접 접촉되고, 소위 말하는 쇼트가 일어나 전지를 사용할 수 없다. |