
|
원자번호 61번의 원소인 프로메튬은 란타넘족에 속하는 희토류 원소의 하나인데, 안정한 동위원소는 없고 방사성 동위원소들만 존재한다. 이 원소는 1902년에 그 존재가 예언되었으나 자연계에서는 발견되지 않았고, 1947년에 우라늄 핵분열 생성물에서 처음 분리·발견되었는데, 란타넘족 원소 중에서 맨 나중에 발견된 원소이다. ‘제2의 불’이라 일컬어지는 우라늄의 핵분열 생성물에서 발견되었기 때문에, 그리스 신화에서 인간에게 불을 가져다 준 ‘불의 신' 프로메테우스(Prometheus)를 따서 원소 이름이 지어졌다. 프로메튬은 주기율표에서 원자번호가 83(비스무트, Bi)이하인 원소 중에서 안정한 또는 반감기가 긴 방사성 동위원소가 없는 두 가지 원소 중의 하나인데, 다른 하나는 원자번호 43번의 테크네튬(Tc)이다. 또 원자번호가 84(폴로늄, Po)이하인 원소 중에서는 가장 불안정한 원소이다. 사용 후 핵연료에서 분리해서 얻으며, 핵 반응을 통해 합성될 수도 있다. 프로메튬은 물질의 두께 측정기, 빛 신호기, 원자력 전지, 발광 페인트 등에 쓰인다. 프로메튬의 역사, 성질, 그리고 생산과 이용에 대해 알아보기로 하자. | |
|
원자번호 61번, 프로메튬

프로메튬(promethium)1)은 원자번호 61번의 원소로, 원소기호는 Pm이다. 프로메튬은 안정한 동위원소가 없으며, 방사성 동위원소로만 있다. 동위원소 중 반감기가 가장 긴 것은 145Pm으로, 반감기가 17.7년이다. 주기율표에서 란타넘족에 속하는 희토류 원소의 하나로 은백색 금속이다. 녹는점은 1042oC이며, 실온에서 밀도는 7.2g/cm3이다. 이웃하는 다른 란타넘족 원소와 성질이 아주 비슷하며 화합물에서의 가장 흔한 산화 상태는 +3이고, 화합물들은 보통 분홍색 또는 붉은색을 띤다. 공기 중의 산소에 의해 산화되고, 산에 녹아 Pm3+이 된다. Pm3+은 아주 안정하여, 쉽게 산화되거나 환원되지 않고 물에서는 노란색 내지 분홍색을 띤다. 산에 녹인 용액에 염기를 가하면 Pm(OH)3가 침전된다. 옥살산프로메튬 (Pm2(C2O4)3·10H2O)은 모든 란타넘족 원소의 옥살산 염 중에서 용해도가 가장 낮다. | |
|

원소번호 61번 프로메튬 |
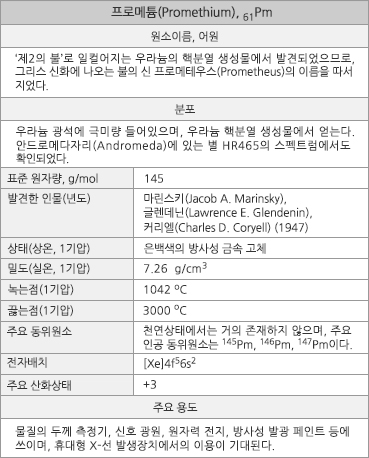
프로메튬의 원소정보 |
|
프로메튬은 지각에서 분리하여 관측 가능한 양으로는 존재하지 않으나, 우라늄 광석에서 극미량 발견될 수 있다. 우주에서는 안드로메다자리(Andromeda)에 있는 별 HR465에서 나오는 빛의 스펙트럼에서 존재가 확인되었다. 천연에서는 우라늄(U)의 자발적 핵분열과 원자번호 62번인 유로퓸(Eu)의 자연 방사성 붕괴로 생성되나 반감기가 짧아 그 존재량은 극히 적다. 지각에서의 존재비는 4.5x10-20ppm이고, 대표적인 우라늄 광석인 피치브렌드(pitchblende) 광석 시료에는 4/1018 질량비로 존재한다고 보고되었다. 우라늄의 자발적 핵분열에서 생성되어 존재하는 프로메튬의 양은 지각 전체에 약 560g 정도인 것으로 추정되는데, 이는 대부분 147Pm이고 다른 동위원소들은 핵분열 생성물이 아니거나 반감기가 짧아 거의 존재하지 않는다. 147Pm은 또한 유로퓸(Eu)-151(151Eu) 의 α붕괴로도 생성되는데, 이에 의한 프로메튬 양은 지각 전체에서 12g에 불과한 것으로 추정된다. 151Eu은 천연상태 유로퓸의 47.8%를 차지하며, 반감기는 5x1018년이다. 어떤 원소가 α붕괴를 하면 원자번호는 2, 그리고 질량수는 4가 작은 원소가 생성된다. 따라서 프로메튬은 자연에서는 얻을 수 없고 우라늄의 인공 핵분열 생성물에서 분리해서 얻는데, 네오디뮴-146의 인공 핵 반응으로도 얻을 수 있다. 1960년대에는 미국에서 연간 650g의 프로메튬을 핵분열 생성물에서 얻을 수 있는 설비를 갖추었으나, 1980년대부터 미국에서는 대규모(g 단위) 생산이 중단되었고, 지금은 러시아에서만 비교적 대규모의 생산이 이루어지고 있다. | |

피치브렌드 광석. 피치브렌드와 같은 우라늄 광석에는 우라늄의 자연 핵 분열로 생성된 프로메튬이 극미량 들어있는데,
지각 전체에 있는 양이 불과 약 560g으로 추정된다. <출처: (cc) Geomartin at Wikimedia.org>
|
프로메튬은 사용 후 우라늄 핵연료에서 주로 147Pm(반감기 2.6234년)으로 얻는데, 그 규모는 보통 mg 단위이다. 147Pm는 β- 붕괴를 하고 사마륨-147(147Sm)이 되는데, 147Pm 화합물은 방사성 발광페인트에서 라듐(Ra)을 대체하여 사용되며, 인공위성, 우주 탐사선, 심장 박동기용 원자력 전지, 물질의 두께 측정기, 빛 신호기 등에도 사용된다. 또한 휴대형 X-선 발생장치에서의 이용이 기대된다. | |
|
프로메튬의 발견과 역사

1902년에 체코 화학자 브라우너(Bohuslav Brauner, 1855~1935)는 네오디뮴(Nd)과 사마륨(Sm) 사이에 새로운 원소가 존재해야 한다고 예언하였다. 1913년에 모즐리(Henry Moseley, 1887~1915)는 여러 원소들에 음극선을 충돌시킬 때 방출되는 X-선 스펙트럼을 조사하여 X-선의 주파수와 원자번호 사이의 관계식인 모즐리의 법칙(Moseley’s law)2)을 발견하였는데, 이 법칙에 따르면 네오디뮴의 원자번호는 60이 되고, 사마륨의 원자번호는 62가 되어, 이들 사이에 새로운 원소(원자번호 61)가 있어야 한다는 브라우너의 예언을 뒷받침하였다. 따라서 화학자들은 이웃하는 란타넘족 원소를 중심으로 하여 원자번호 61번의 원소를 찾고자 노력하기 시작하였다.
원자번호 61번 원소를 발견했다는 처음 보고는 1926년에 두 명의 이탈리아 과학자에 의해 행해졌다. 그들은 희토류 광석의 하나인 모나자이트 광석을 녹인 용액에서 몇 가지 희토류 원소 혼합물을 분리한 후 남은 용액의 X-선 스펙트럼을 분석한 결과 61번 원소를 발견하였으며, 원소 이름을 자신들의 도시 플로렌스(Florence)를 따서 플로렌튬(florentium)으로 한다고 학계에 보고하였다. 같은 해에 미국 일리노이(Illinois) 대학교 어바나-삼페인(Urbana-Champaign) 캠퍼스 과학자들도 희토류 광석에서 61번 원소를 발견했다고 보고하였는데, 그들은 원소 이름을 자신들의 대학 이름을 따서 일리늄(illinium)으로 명명하였다. 그러나 이들 두 보고에서 61번 원소에 의한 것으로 주장한 X-선 스펙트럼은 나중에 불순물로 들어 있는 다른 원소들에 의한 것임이 밝혀졌다. 이후 과학자들은 점차 61번 원소는 불안정한 방사성 원소일 것이라고 믿게 되었는데, 1938년에 미국 오하이(Ohio) 주립대학교 과학자들은 핵 실험을 통해 방사성 네오디뮴이나 사마륨이 아닌 것이 분명한 새로운 핵종이 생성되는 것을 발견하고는, 이를 사이클로늄(cyclonium)이라 명명하였다. 그러나 이들은 이에 대한 화학적 증거를 제시하지 않아, 61번 원소의 발견자로 인정되지 않고 있다. | |

마린스키(Jacob A. Marinsky, 좌), 글렌데닌(Lawrence E. Glendenin, 중), 커리엘(Charles D. Coryell, 우)
|
1945년에 미국 오크릿지 국립연구소(Oak Ridge National Laboratory, ORNL: 당시 이름은 Clinton Laboratory)의 마린스키(Jacob A. Marinsky), 글렌데닌(Lawrence E. Glendenin), 커리엘(Charles D. Coryell)은 흑연 원자로에서 생긴 우라늄 핵 분열 생성물에서 61번 원소를 이온교환 크로마토그래피 방법으로 분리하고 확인하였다. 그들은 또한 우라늄 핵 분열 시 나오는 중성자를 네오디뮴(Nd)에 쪼이는 방법으로도 이 원소를 얻을 수 있었다. 당시는 세계 제2차 대전 중으로, 그들은 군사 관련 연구에 너무 바빠 발견 결과를 바로 발표하지 못하고 1947년에야 발표하였다. 이듬해인 1948년에는 원소 이름을 그리스 신화에서 제우스가 감추어 둔 불을 훔쳐다가 인간에게 줌으로써 인간에게 맨 처음으로 문명을 가르친 불의 신 프로메테우스(Prometheus)를 따서 프로메튬(Promethium)으로 제안하였고, 이는 1949년에 국제순수∙응용화학연합 (IUPAC)에 의해 채택되었다. 1963년에는 플루오린화프로메튬(PmF3)을 금속 리튬(Li)으로 환원시켜 금속 프로메튬을 얻었으며, 이 시료를 써서 녹는 점을 포함한 몇 가지 특성을 측정하였다. | |
|
물리적 성질

프로메튬(promethium)은 은백색의 금속이다. 녹는점은 1042oC이고, 끓는점은 3000oC로 추정되며, 25oC 밀도는 7.26g/cm3이다. α-형과 β-형의 두 가지 동소체가 존재하는데, α-형은 육방조밀격자(hcp) 구조를 하며, 약 890oC에서 체심입방(bcc) 구조를 하는 β-형으로 전이된다. 상자기성(paramagnetic)을 보이며, 전기 비저항은 약 750 nΩ·m로 추정된다. | |

프로메튬 금속의 일러스트레이션 <출처: (cc) http://images-of-elements.com/>
|
동위원소
프로메튬은 안정한 동위원소가 없으며, 우라늄의 자발적 핵분열과 유로퓸-151(151Eu)의 α-붕괴에서 생성되어 극미량 존재하는 것 외에는 자연에 존재하지 않는다. 질량수가 126에서 163에 이르는 38가지 인공 방사성 동위원소들이 확인되었는데, 반감기가 가장 긴 것은 145Pm(반감기 17.7년)이고, 다음으로 반감기가 긴 것들은 146Pm(반감기 5.53년), 147Pm(반감기 2.6234년), 144Pm(반감기 363일), 143Pm(반감기 265일)이다. 나머지는 반감기가 6일보다 짧으며, 대부분은 30초 이내이다. 145Pm보다 질량수가 작은 동위원소들은 주로 전자포획(β+ 붕괴)을 하고 네오디뮴(Nd) 동위원소가 되고, 146Pm보다 질량수가 큰 동위원소들은 주로 β-붕괴를 해서 사마륨(Sm) 동위원소가 된다. 146Pm는 66%는 전자포획을 하고, 34%는 β- 붕괴를 한다. 145Pm은 거의 대부분이 전자포획을 하는데, 극히 일부인 2.8x10-8%는 α붕괴를 하고 프라세오디뮴-141(141Pr)이 된다. 18가지 준안정한 핵 이성체들이 확인되었는데, 반감기가 긴 것들은 148mPm(반감기 41.29일), 152m2Pm(반감기 13.8분), 152mPm(반감기 7.52분)이다.
사용 후 핵연료나 핵 반응 생성물에 들어있는 프로메튬 동위원소는 주로 147Pm이다. 사용 후 핵연료에 들어 있는 147Pm은 핵 반응로(원자로)에서 우라늄 핵분열 생성물의 하나인 147Nd(반감기 10.98일)의 β-붕괴로 생성된 것인데, 우라늄의 핵분열에서는 147Pm외에도 149Pm(반감기 53.08 시간)과 151Pm(반감기 28.4 시간)이 생성되나, 이들 두 동위원소는 반감기가 짧아 사용 후 핵연료에 거의 존재하지 않는다. | |
|
화학적 성질

| |
|
프로메튬은 얻을 수 있는 양이 적고 또 수명이 비교적 짧은 방사성 동위원소로만 존재하기 때문에, 화학적 성질은 극히 제한적으로만 연구되었는데 이웃하는 네오디뮴이나 사마륨과 아주 비슷하다는 것은 분명하다. 반응성이 큰 금속이며, 화합물에서는 주로 +3의 산화상태를 갖는다. 몇 가지 +3상태의 화합물들이 합성되었는데, 이들은 보통 분홍색 또는 붉은색을 띤다. Pm3+은 화학적으로는 아주 안정하여, 쉽게 산화되거나 환원되지 않고 수용액에서는 노란색 내지 분홍색을 띤다. Pm3+를 포함하는 용액에 염기를 가하면 연한 갈색의Pm(OH)3가 침전된다. 염산, 질산, 황산 등에 잘 녹으며, 옥살산염(Pm2(C2O4)3·10H2O)은 란타넘족 원소의 옥살산 염 중에서 용해도가 가장 낮다. Pm3+의 산성과 염기성 용액에서의 표준 환원 전위는 각각 -2.29와 -2.76 V이다.
Pm3+ + 3 e-  Pm Eo = -2.29 V Pm Eo = -2.29 V
Pm(OH)3 + 3 e-  Pm + 3 OH- Eo = -2.76 V Pm + 3 OH- Eo = -2.76 V | |
|
|
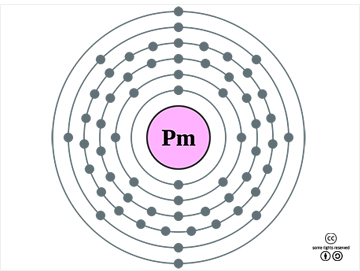
프로메튬의 바닥 상태 전자 배치 <출처 : (cc)Pumbaa at Wikipedia.org> | |
|
프로메튬의 생산

프로메튬은 주로 우라늄의 핵분열 생성물에서 분리해서 얻는다. 프로메튬 동위원소 중 산업적으로 주로 사용되는 것은 147Pm인데, 이는 235U에 열 중성자를 쪼이면 전체 핵분열 생성물의 2.6%로 생성된다. 147Pm은 또한 여러 핵 반응을 통해서도 생성될 수 있는데, 예로 농축된 146Nd에 중성자를 쪼이면 147Nd(반감기 10.98일)가 생성되며, 147Nd는 β- 붕괴를 하고 147Pm로 전환된다. 146Nd은 안정한 동위원소로, 자연상태에서 전체 네오디뮴 동위원소의 17.2%를 차지한다.
146Nd + 1n → 147Nd → 147Pm + β-
이외에도 입자 가속기에서 탄화우라늄(UCx) 표적에 고에너지 양성자를 충돌시키거나, 238U에 고속 중성자를 쪼여 핵분열을 일으켜 생성시킬 수도 있다.
사용 후 핵 연료나 핵 반응 생성물에는 147Pm이 다른 여러 생성물들과 함께 들어있다. 이들에서 이온교환 크로마토그래피 방법을 사용하여 Pm3+를 분리하고, 이를 옥살산 염으로 침전시켜 회수한 후 이를 태우면 산화프로메튬(Pm2O3)이 얻어진다. 금속 프로메튬은 프로메튬의 할로겐화물(PmX3)을 진공 또는 아르곤(Ar) 기류 하의 탄탈럼(Ta) 도가니에서 칼슘(Ca) 또는 리튬(Li) 과 함께 가열하면 얻을 수 있다. 예로, PmF3를 Li으로 환원시키는 경우의 반응식은 다음과 같다.
PmF3 + 3 Li → Pm + 3 LiF
오크릿지 국립연구소는 1960년대에 년간 650g의 프로메튬을 이온교환 크로마토그래피 방법으로 분리·생산할 수 있는 시설을 갖추고 있었는데, 이는 세계에서 유일한 대규모 프로메튬 생산 시설이었다. 그러나, 1980년에 미국에서의 g 단위 프로메튬 생산은 중단되었으며, 지금은 러시아에서 비교적 대량으로 생산된다. | |
|
프로메튬의 용도

프로메튬은 147Pm을 제외하고는 주로 연구용으로만 사용되는데, 주로 산화물(Pm2O3)과 염화물(PmCl3) 형태로 생산·사용된다. 147Pm는 반감기가 2.623년인 β-선 방출원으로, 물질에서의 방사선 투과 깊이가 비교적 짧다.
147Pm는 원자력 전지에 사용되는데, 이 전지는 147Pm에서 방출되는 β- 입자를 전류로 바꾸는 장치로 최초로 상업화된 원자력 전지이다. 이 전지는 147Pm 화합물을 두 장의 반도체 판 사이에 넣어 만드는데, 1964년에 처음 만들어졌으며, 다른 형태의 전지가 너무 무겁거나 커서 적합하지 않은 특수한 경우에 사용된다. 유도 미사일 계기, 인공위성, 심장 박동기 등의 에너지원이나 태양광이 약한 장소에서 활동하는 우주 탐사선의 보조 열원과 동력원 등으로 사용되었다. 같은 무게나 부피의 일반적인 화학 전지에 비해 월등하게 큰 전력을 얻을 수 있는 장점이 있으나, 일반적인 용도로 사용하기에는 너무 값이 비싸다. 또 147Pm의 반감기 때문에, 수명이 약 5년 이내로 제한되며, 흔히 감마선을 방출하는 146Pm로 오염되어있어 감마선을 잘 차폐시켜야 하는 단점이 있다. 최근에는 삼중수소(3H, 반감기 12.32년) 등 다른 β- 붕괴 동위원소를 사용하는 원자력 전지로 대체되고 있다. | |

프로메튬 동위원소는 방사성 발광 페인트로 사용된다.
|
한편, 147PmCl3는 인광체(예로, 황화아연 ZnS)와 섞어 시계, 계기판, 누름단추에 칠하는 방사성 발광 페인트로 사용된다. 처음에는 이 목적으로 라듐(Ra) 산화물을 사용하였으나 라듐의 방사능 오염으로 많은 작업자들이 사망하게 됨에 따라, 라듐이 147Pm나 삼중수소(3H)로 대체되었다. 안정성 측면에서는 147Pm가 3H에 비해 선호되기도 한다. 147PmCl3를 사용하는 방사성 발광 페인트는 147Pm 반감기로 인한 짧은 수명, 146Pm의 오염으로 인한 감마선 차폐문제 등, 147Pm 원자력 전지에서와 같은 단점들이 있으나, 외부 조작과는 무관하게 신뢰성이 요구되는 일부 장치의 빛 신호원으로 여전히 사용되고 있다.
147Pm 화합물들은 이에서 나오는 방사선이 물질을 투과하는 정도에서 그 물질의 두께를 측정하는데 사용되기도 한다. 또한 이에서 나오는 방사선을 금속 표적에 쪼여 X-선을 발생시키는 휴대형 X-선 발생장치에서의 이용이 기대된다. | |
|
프로메튬 화합물

몇 가지 프로메튬 화학물들이 합성되어 이들의 성질이 조사되었다. 가장 중요한 프로메튬 화합물은 산화프로메튬(Pm2O3)인데, 이는 옥살산프로메튬(Pm2(C2O4)3·10H2O)을 열 분해시키면 흰색 또는 노란색 분말로 얻어진다. Pm2O3은 3가지 결정형으로 존재하는데, 분말을 600oC로 가열하면 입방(Cubic) 구조를 하는 밀도가 6.77g/cm3인 결정이 된다. 이 입방형 결정을 더욱 가열하면, 750~800oC에서 단사정(monoclic) 구조(밀도 7.40g/cm3)로 전환되고, 이를 더욱 가열하면 1740oC에서 육방정(hexagonal) 구조(밀도 7.53g/cm3)로 전환된다. 이들 구조 전이는 비가역적으로, 반대 방향의 구조 전이는 산화물을 녹임으로써만 일으킬 수 있다. 녹는점은 약 2320oC이다.
프로메튬의 4가지 삼할로겐화물(PmX3: X=F. Cl, Br, I)들도 합성되었는데, 이들은 다른 란타넘족 원소들과 마찬가지로, Pm2O3를 할로겐화산(HX)에 녹이거나 할로겐화암모늄(NH4X)과 반응시켜 만들 수 있다. PmF3를 제외하고는 모두 물에 잘 녹는다. PmF3는 자주색, PmCl3는 노란색, PmBr3와 PmI3는 붉은 색을 띤다. 이들 중에서 흔히 사용되는 것은 PmCl3이다. | |
|
생물학적 역할과 독성

프로메튬의 생물학적 역할은 알려진 것이 없으며, 방사능 성질 때문에 모든 생명체에 위험하나, 방사선 이외의 위험성은 거의 없는 것으로 파악되고 있다. 밀폐된 용기에 든 147Pm은 위험하지 않으며, 147Pm을 취급 시에는 적절한 보호 복장을 착용해야 하는데, 피부에 닿으면 즉시 물과 비누로 씻어야 한다. | |
 수치로 보는 프로메튬
수치로 보는 프로메튬
프로메튬은 인공 원소이므로, 원자량은 생산된 동위원소에 따라 다르다. 원자의 바닥 상태 전자배치는 1s22s22p63s23p63d104s24p64d105s25p64f56s2([Xe]4f56s2)이며, 화합물에서 주된 산화 수는 +3이다. 지각에서는 거의 발견되지 않으며, 사용 후 핵연료에서 분리하거나 인공 핵 반응으로 얻는다. α-와 β–형의 두 가지 동소체가 있으며, α→β 전이 온도는 약 890oC이다. 1기압에서 녹는점은 1042oC이고, 끓는점은 3000oC로 추정되며, 실온에서의 밀도는 7.26g/cm3이다. 첫 번째, 두 번째, 세 번째 이온화 에너지는 각각 540, 1050, 2150kJ/mol이며, 폴링의 전기 음성도는 1.13으로 추정된다. 원자 반경은 183.4pm(비교: Nd, 181.4pm; Sm, 180.4)이며, 6 배위체의 Pm3+ 이온 반경은 97pm(비교: Nd3+, 98.3pm; Sm3+, 95.8pm)이다. Pm3+/Pm의 표준 환원 전위는 -2.29V이고, Pm(OH)3/Pm의 표준 환원 전위는 -2.76V이다. 반감기가 긴 동위원소들은 145Pm(반감기 17.7년), 146Pm(반감기 5.53년), 147Pm(반감기 2.623년)이며, 실제 생산·사용되는 것은 주로 147Pm이다.
 모즐리 법칙(Moseley’s law)
모즐리 법칙(Moseley’s law)
음극선(전자)에 의해 들뜬 원소에서 방출되는 X-선의 진동수(ν)와 원자번호(Z) 사이에는 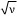 = a(Z-b)인 관계가 있다는 것으로, 1913년에 모즐리가 발견한 경험법칙이다. 여기서 a와 b는 상수이다. 이를 통해 원소의 원자번호를 측정 가능한 양으로부터 결정할 수 있게 되었고, 원소의 화학적 성질은 원자핵의 양성자 수(원자번호)에 의해 결정된다는 것이 확실해졌으며, 주기율표에서는 종전의 원자량 대신 원자번호의 순서로 원소들을 배열할 수 있게 되었다.
= a(Z-b)인 관계가 있다는 것으로, 1913년에 모즐리가 발견한 경험법칙이다. 여기서 a와 b는 상수이다. 이를 통해 원소의 원자번호를 측정 가능한 양으로부터 결정할 수 있게 되었고, 원소의 화학적 성질은 원자핵의 양성자 수(원자번호)에 의해 결정된다는 것이 확실해졌으며, 주기율표에서는 종전의 원자량 대신 원자번호의 순서로 원소들을 배열할 수 있게 되었다.
- 글 박준우 / 이화여대 명예교수(화학)
- 서울대학교 화학과를 졸업하고 템플대학교에서 박사학위를 받았다. 오랫동안 이화여대에서 화학을 연구하고 가르쳤다. 저서로 [인간과 사회와 함께한 과학기술 발전의 발자취]와 [아나스타스가 들려주는 녹색화학 이야기] 등이 있고, 역서로 [젊은 과학도에 드리는 조언] 등이 있다.
발행일 2012.11.14
 |
|
Promethium
Naturally radioactive promethium was briefly used as a replacement for radium in self-luminous paint, before tritium took over. This button was produced using left-over stock kept for making diving watches.
Scroll down to see examples of Promethium. |




 수치로 보는 프로메튬
수치로 보는 프로메튬
 모즐리 법칙(Moseley’s law)
모즐리 법칙(Moseley’s law)
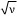 = a(Z-b)인 관계가 있다는 것으로, 1913년에 모즐리가 발견한 경험법칙이다. 여기서 a와 b는 상수이다. 이를 통해 원소의 원자번호를 측정 가능한 양으로부터 결정할 수 있게 되었고, 원소의 화학적 성질은 원자핵의 양성자 수(원자번호)에 의해 결정된다는 것이 확실해졌으며, 주기율표에서는 종전의 원자량 대신 원자번호의 순서로 원소들을 배열할 수 있게 되었다.
= a(Z-b)인 관계가 있다는 것으로, 1913년에 모즐리가 발견한 경험법칙이다. 여기서 a와 b는 상수이다. 이를 통해 원소의 원자번호를 측정 가능한 양으로부터 결정할 수 있게 되었고, 원소의 화학적 성질은 원자핵의 양성자 수(원자번호)에 의해 결정된다는 것이 확실해졌으며, 주기율표에서는 종전의 원자량 대신 원자번호의 순서로 원소들을 배열할 수 있게 되었다. 



 Pm Eo = -2.29 V
Pm Eo = -2.29 V
