|
|
|
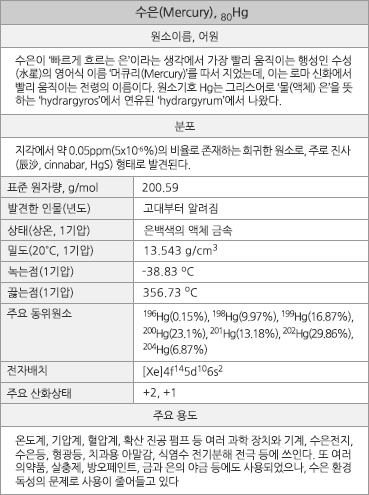
원자번호 80번 수은 |
수은의 원소 정보. |
|

진사(cinnabar, HgS). 수은은 진사에서 얻으며, 진사는 붉은색 안료와 의약품으로도 사용되었다
|
|
|
|
|
|

수은 위에 동전을 띄워 놓은 모습. 동전보다 수은의 밀도가 높다는 것을 보여준다. <출처: (cc) Alby at Wikimedia.org>
|
|
|
|
|
|

수은체온계 <출처: (cc) Menchi at Wikimedia.org>
|

폴리염화비닐(PVC) 파이프. PVC는 가장 널리 사용되는 플라스틱인데, 중국 등에서는 주로 석탄에서 출발하여 PVC를 만든다. 이때 염화비닐 단량체(VCM)를 생산하는 과정에서 수은화합물이 촉매로 사용된다. <출처: (cc) Rasbak at Wikimedia.org>
|
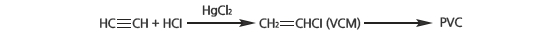
|
|
수은을 사용한 전기 스위치 <출처: (cc) Mercury institute> |
다양한 형광등, 수은은 형광등에도 사용된다. <출처: (cc) Christian Taube> |
|

수은 압력계 <출처: (cc) Hannes Grobe>
|

소형 전자 제품에서 사용되는 단추형 전지에는 과거에는 수은전지(좌)가 많이 쓰였으나, 최근에는 수은이 들어가지 않는 리튬전지(우) 등으로 거의 대체되었다. <출처: (cc) Andshel>
|
|
|
|
 수치로 보는 수은
수치로 보는 수은
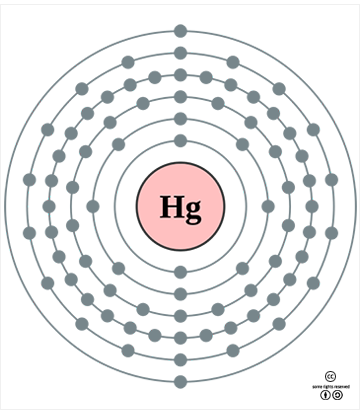
수은의 표준원자량은 200.59g/mol이며, 원자의 바닥상태 전자배치는 1s22s22p63s23p63d104s24p64d105s25p64f145d106s2([Xe]4f145d106s2)이고, 화합물에서의 주된 산화 수는 +2와 +1이다. 지각에서의 존재비는 약 0.05ppm(5x10-6%)로, 대략 68번째로 풍부한 원소이다. 주된 광석은 진사(HgS)이다. 2012년 전세계 신규 생산량은 1600톤이고, 이의 75%인 1200톤이 중국에서 생산되었다. 녹는점은 -38.829oC이고, 끓는점은 356.73oC이며, 20oC에서의 밀도는 13.543g/cm3이다. 녹음열과 증발열은 각각 2.29kJ/mol과 59.11kJ/mol이며, 25oC에서의 증기압은 2x10-3mmHg이다. 전기 비저항은 961nΩ·m이고 열전도도는 8.3 W·m-1·K-1이며, 열 팽창율은 25oC에서 60.4 μm·m-1·K-1이다. 표면장력은 25oC에서 484mN·m-1(물, 72.0mN·m-1)이다. 원자반경은 151pm이며, Hg2+의 이온반경은 102pm이다. 첫 번째, 두 번째, 세 번째 이온화 에너지는 각각 1007.1, 1810, 3300kJ/mol이며, 폴링의 전기음성도는 2.00이다. 자연 상태의 동위원소는 196Hg(0.15%), 198Hg(9.97%), 199Hg(16.87%), 200Hg(23.1%), 201Hg(13.18%), 202Hg(29.86%), 204Hg(6.87%)의 7가지이다.
 표면장력(surface tension)
표면장력(surface tension)
표면을 늘리는데 필요한 일을 늘어난 면적으로 나눈 값으로, 액체에서 표면을 작게 하려고 작용하는 힘을 나타낸다. 단위는 에너지/면적 또는 힘/길이이다. 표면에 있는 액체 분자의 에너지가 액체 내부에 있는 분자의 에너지보다 크기 때문에 생긴다. 계면 장력이라고도 부른다. 계면활성제는 물에 녹아 물의 표면장력을 줄이는 물질을 말한다. 표면장력이 클수록 액체는 표면을 줄이기 위해 구형 방울로 존재하려는 경향이 크다.
발행일 2013.03.27




 Hg Eo
Hg Eo