|
|
생명의 기체. 원자번호 8번, 산소 . |
산소의 원소 정보. |
|
|
1772년, 프리스틀리보다 먼저 산소를 발견한 것으로 알려진 셸레. |
프리스틀리는 1774년 산화 수은에 빛을 쪼여 산소를 얻었고, 1775년 논문으로 발표한다. 발견은 셀레가 먼저 하였으나 프리스틀리가 먼저 발표하였기 때문에 산소 발견의 공적은 프리스틀리에게 주어진다. |
|
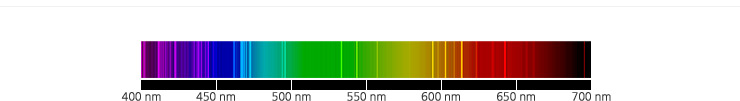
산소 원자의 선스펙트럼.

|
|
산소는 물에 비교적 잘 녹는 특성을 가지고 있는데, 수중 생물은 이 용해된 산소를 호흡하여 생명을 유지한다. <출처: gettyimages> |
1848년 패러데이는 산소 분자 O2의 상자기성을 발견하였다. 액체 산소의 흐름이 외부 자기장에 영향을 받아 한쪽으로 휘는 모습. |
|

|
|
|
|
산소는 선철을 강철로 만드는 제강 공정에서 사용된다. 선철 내의 탄소, 규소, 인 및 기타 불순물들을 산화시켜 제거하고, 탄소 함량을 낮추는 데 산소가 사용된다.<출처: (CC)Jean-Pol GRANDMONT at Wikipedia.org>. |
산소는 인간이 호흡할 수 있는 공기가 제한된 환경, 즉 바다나 우주에서의 활동을 위해 사용되기도 한다. <출처: gettyimages> |
|

|
|
|
- 수치로 보는 산소
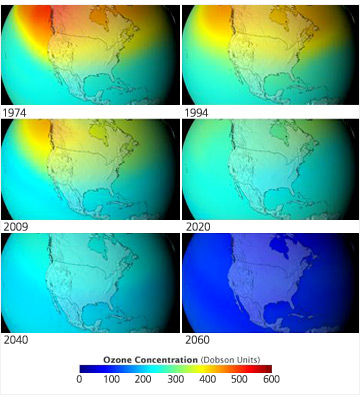
산소는 우주에서 3번째로 풍부하며, 지구 표면에서 무게비가 가장 큰 원소이다. 무게 비로는 대기의 23%(부피 비로는 20.95%), 암석권의 46%, 수권의 85% 이상을 차지한다. 대기 중에서는 주로 무색, 무취의 이원자 분자 기체인 O2로 존재하며, 밀도는 0oC, 1기압에서 1.429g/L이다. 표준원자량은 15.999g/mol이다. 녹는점은 -218.79oC(54.36K)이고, 끓는점은 -182.95oC(90.20K)이며, 임계점은 –118.56oC(154.59K), 50.5bar이다. 전자배열 1s22s22p4이며, 이온화 에너지는 1315.52kJ/mol이다. O2의 바닥 상태는 삼중항 상태이며, 낮은 에너지의 들뜬 상태는 두 개의 단일항 상태인데, 이들의 에너지는 삼중항 상태에 비해 94.72와 157.85 kJ/mol만큼 높다. 이는 파장이 631.2nm와 473.7nm인 빛의 에너지에 해당된다. 매년 1억톤 이상이 공기에서 분리되어, 제철공업, 화학공업, 용접, 치료 등에 사용된다.
발행일 2011.09.14
Oxygen
| Atomic Weight | 15.9994 | |
| Density | 1.429 g/l[note] | |
| Melting Point | -218.3 °C | |
| Boiling Point | -182.9 °C | |
| Full technical data | ||
At -183.0DegreeC oxygen is a beautiful pale blue liquid, but at room temperature it is a colorless gas. It's only 21% of the atmosphere--the 21% we all need if we want to live more than a few minutes longer.
Scroll down to see examples of Oxygen.